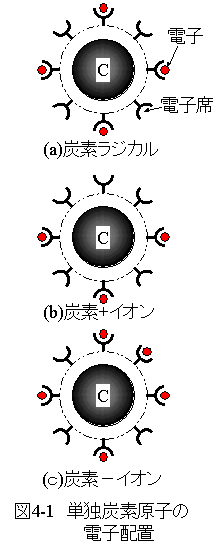
単独炭素原子の電子配置を図4-1に示します。
単独炭素原子は(a)炭素ラジカル、(b)炭素+イオン、(c)炭素-イオン等の9通りの 電子配置の状態が存在します。
(a)炭素ラジカルは2個の2s電子席に対して2個の電子が収まっています。 6個の2p電子席に対して2個の電子が収まっています。 この様な条件において、電子の収まっていない電子席は不安定な状態となります。 電子席と電子席の反発よりも電子席と電子の引力の方が強く、4個の空席電子席は電子に接近します。 この状態は不安定で他の原子とただちに反応します。
(b)炭素+イオンは電子席の空席が5個の場合です。 この様な条件において、マイナス電荷が不足するためプラスイオンとなります。 プラスイオンはマイナスイオンと反応して安定状態となります。
(c)炭素-イオンは電子席の空席が3個の場合です。 この様な条件において、マイナス電荷が過剰となるためマイナスイオンとなります。 マイナスイオンはプラスイオンと反応して安定状態となります。
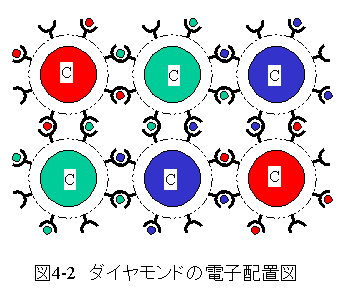
ダイヤモンドの結合電子配置を図4-2に示します。
ダイヤモンドは安定で最高の硬度を持つ固体です。
ダイヤモンドは分子式で表現しません。
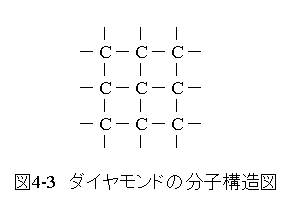 ダイヤモンドの分子構造図を図4-3に示します。
ダイヤモンドの分子構造図を図4-3に示します。分子構造図では、1対の共有結合を1本の実線で示します。 炭素が完全に共有結合するとダイヤモンドになります。 炭素は常にこの様な結合になるわけではありません。
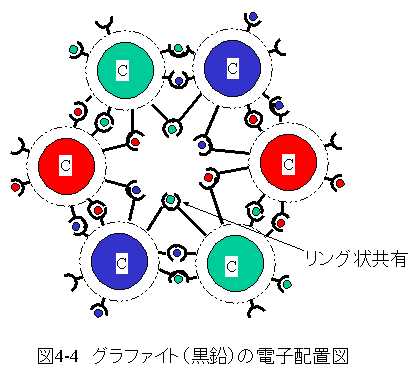
グラファイト(黒鉛) の結合電子配置を図4-4に示します。
6個の炭素原子核に6個の電子がリング状に共有された特殊な電子配置となっています。
このリング状電子配置は下記の物性をもたらしています。
(a)光を良く吸収します。(黒色となります。)
(b)電気を良く通します。(導電性を示します。)
グラファイト(黒鉛) は分子式で表現しません。
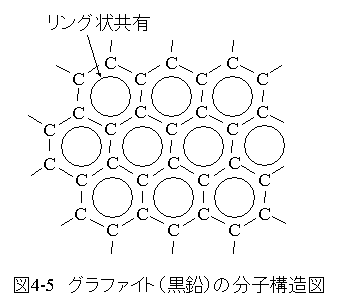 グラファイト(黒鉛) の分子構造図を図4-5に示します。
グラファイト(黒鉛) の分子構造図を図4-5に示します。分子構造図では、リング状電子配置を1個の実線の円で表現しています。
グラファイト(黒鉛) の環状構造は通常六角形ですが この場合は分子形状は平面または円筒形となります。
円筒の分子形状はカーボンナノチューブ となります。
環状構造が六角形と五角形を組み合わせるとサッカーボールの ように球形となります。これをフラーレン といいます。
炭素は組み合わせしだいでさまざまな形状の分子形状となります。 この性質から有機物の骨格を形成している元素です。