光エネルギーについては下記に簡単に記載されています。
説明の内容は以下の通りです。
光エネルギー(ひかりエネルギー、light energy)とは、電磁波の一種である光がもつエネルギーを指す。単位はジュール(J)。光エネルギーは光に含まれる光子の数と光子の周波数(波長)によって決まる。
光子のエネルギーはその振動数によって決まり、以下のように表される。
E=h・ν=h・c /λ
h : プランク定数
E : エネルギー
ν : 振動数
c : 光の速さ
λ : 波長
上記の計算式は、多くの実験で有効性が確認されています。
しかし、なぜこの計算式が成立するのか?説明が上十分です。
光が電磁波であるとした場合、波動光学では光のエネルギーを 波動(電場の振動)の自乗として求めるのが一般的です。
厳密には電場ベクトルと磁場ベクトルの外積とすべきですが、 結果的には、一致するようです。
光が電磁波であるとした場合の光エネルギーの詳細検討は下記で 詳しく説明されています。
光子は原子や分子で起こる現象をよく説明できますが、空間での伝播の説明には 向きません。
逆に波動は空間での伝播を良く説明できますが、原子や分子で起こる現象をよく説明できません。
何とかして、光子と波動が融合できるモデルを考える必要があります。
電磁気学はモデルが明確ですが、光子のモデルは極めて曖昧です。
曖昧なモデルは理解しがたいのです。光子の計算結果がいくら正確であっても 騙されていないか?
というふあんが残ってしまいます。
まずは、水素原子の発光スペクトルについて検討してみましょう!!
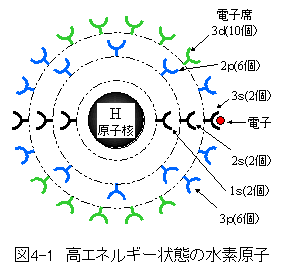 図4-1に高エネルギー状態の水素原子モデルを示します。
図4-1に高エネルギー状態の水素原子モデルを示します。図4-1において、水素原子核のまわりには電子が収まる電子席が配置されています。
(1)第1列には1sの電子席が2個あります。
(2)第2列には2sの電子席が2個、2pの電子席が6個あります。
(3)第3列には3sの電子席が2個、3pの電子席が6個、3dの電子席が10個あります。
(4)s、p、d、fはそれぞれ異なる「運動エネルギー《を持ちます。
(5)電子席の「総エネルギー《は「ポテンシャルエネルギー《+「運動エネルギー《となります。 (6)電子席の「総エネルギー《の低い順は1s→2s→2p→3s→3p→4s→3d→4p→5s→4d→5p→6s→4f→となります。
(7)電子は電子席の「総エネルギー《の低い順に埋まっていきます。
図4-1においては、電子が電子席3sに収まっています。
この状態は上安定であり、より「総エネルギー《が小さい電子席が空いている場合は 「総エネルギー《が小さい電子席に移動しようとします。
もし、電子がより「総エネルギー《が小さい2sに移動したらどうなるでしょう?。
2sのポテンシャルエネルギーは3sより小さいため、エネルギーがあまってしまいます。
あまったエネルギーは電子の運動エネルギーに変換されるはずです。
しかし、2sが許容する運動エネルギーは零です。
電子席が許容しない電子の運動エネルギーは電磁波として放出されるはずです。
しかし、なぜ?放出されるエネルギーが光の周波数に比例するのでしょうか?
図4-1のような単純な電子席構造では、うまく説明できません。
電子席構造に一定の制限を加える必要があります。
電子席で運動する電子の軌道は決まっており、決められた軌道上を運動できると する必要があります。
この場合、移動した電子席のエネルギー差が大きいほど、電子の運動速度は大きく なり、周波数が大きくなることになります。
 図4-2に電子席軌道概念図を示します。
図4-2に電子席軌道概念図を示します。図4-2において、電子は軌道上を円周運動をすることができます。
電子が円周運動をすると水平方向からみた場合、電子がが単振動して いるようにみえます。
電子が単振動すると電場と磁場の振動が発生します。 電場と磁場の振動は電磁波となります。 (シンクロトロン放射の原理と同じです。)
以下は、
の抜粋です。
電子席s1とs2のエネルギー差は大きく、電子席s1での発光は紫外線となります。 これをラインマン系列といいます。
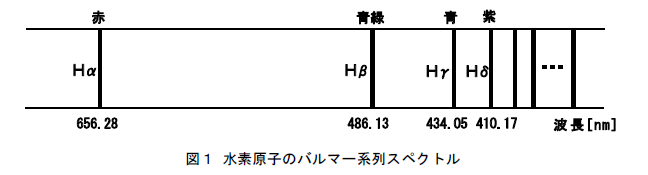
電子席s3からs2の電子移動では赤の発光が見られます。これをバルマー系列 といいます。
水素原子は,可視領域に図1のような線スペクトルがあり,バルマー系列と呼ばれている。 波長の長い方からHα,Hβ,Hγ,…と吊づけられ,それらの波長λは簡単な一つの式
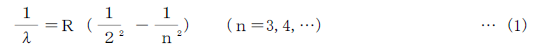
で表わされる。ここで,Rはリュードベリ定数と呼ばれる定数((3)式)である。Hα,Hβ, Hγ の各波長は,この式でn=3,4,5と置いたものになっている。
水素原子の発光スペクトルの式(1)は,ボーアの原子モデルによって説明することができる。 このモデルでは,水素原子のエネルギー準位は
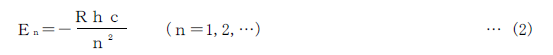
となる。Rはリュードベリ定数であり,
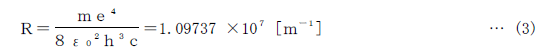
である。ここで,mとeは電子の質量と電荷,hはプランク定数,cは光速,ε0は真空の誘 電率である。放電によって高いエネルギー準位Enに励起されれた電子が,より低いエネル* 準位Emに遷移するとき,そのエネルギー差
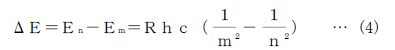
の光子を出す。この光子の振動数をνとすると,エネルギーは hνであるから,ν=ΔE/h。また,波長λは,λ=c/ν= hc/ ΔE となる。従って,

と表せる。ここで,m=1,2,…,n=m+1,m+2,… である。バルマー系列のスペク トルについては,電子はm=2の定常状態に遷移し,このとき,(5)式は先の(1)式となる。 リュードベリ定数を(1)式を用いて波長の実験値から求め,それが理論値(3)に一致すれば, ボーアの原子モデルの正当性が確かめられたことになる。
以上の説明は、電子席から電子席への電子を移動を前提に説明しています。 この場合、発光スペクトルはとびとびの波長となります。
しかし、電子が電子席から飛び出さずに電子席内で運動エネルギーを 持った場合、エネルギーは連続的に変化します。
この場合の発光スペクトルは連続的となります。
(1)光エネルギーは周波数に比例する。
(2)原子からの発光スペクトルはびとびの波長となることがある。
(3)原子からの発光スペクトルは連続変化ともなりうる。
(4)光エネルギーは電磁波として放出される。
(飛び出すのは光子(粒子)では無い。)
発光、吸収は量子的ですが、エネルギーの伝播は電磁波となります!!
これが光子と波動が融合モデルの考え方です。