現在ではアンモニアの工業生産はハーバー・ボッシュ法によるものが一般的です。水素と窒素を鉄触媒存在下 20 MPa、500℃ で反応させるとアンモニアが生成されます。
アンモニア (ammonia) は分子式が NH3 で表される無機化合物。常温常圧では無色の気体で、特有の強い刺激臭を持つ。 水に良く溶けるため、水溶液(アンモニア水)として使用されることも多い。化学工業では最も基礎的な窒素源としてきわめて重要です。
この様なアンモニアの性質がどこからくるのか?
分子構造にさかのぼって考えてみたいと思います。
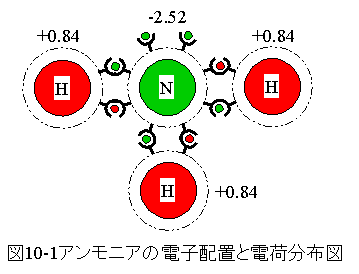
アンモニアの電子配置を図10-1に示します。
窒素原子に3個の水素原子が共有結合しています
窒素はマイナス、水素はプラスに帯電しており、電荷分布(極性)が あります。
従って、アンモニアは水に良く溶解する性質を示します。
共有されていない電子が2個存在します。 この電子が水に溶解すると特別の反応に寄与します。
アンモニアは水に溶解すると水と反応してアンモニウム となります。
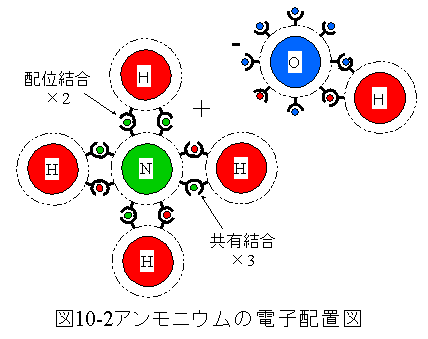
アンモニウムの電子配置を図10-2に示します。
アンモニウムは2個の塊に分かれてしまいます。
一つ塊は1個の窒素に4個に水素が結合した群で3個の共有結合と2個の 配位結合で結合されます。 この塊は電子が1個不足するためプラスイオンとなります。
もう一つの塊は1個の酸素と1個の水素が共有結合した塊です。 この塊は水素から奪い取った電子があるため電子過剰となり マイナスイオンとなります。
プラスイオンとマイナスイオンは電気引力で引き合います。 これをイオン結合といいます。
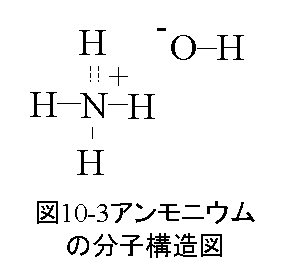
アンモニウムの分子構造を図10-3に示します。
図において配位結合を点線で示しています。 配位結合は必ずしも2本でペアーにはなりません。 2個の配位結合は2本の点線で示しています。
アンモニウムの水溶液はマイナスの水酸(OH)イオンが増大するため アルカリ性を示します。
特有の臭いはアンモニウムイオンの影響と思われます。