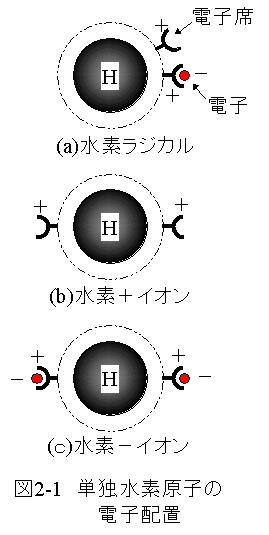
単独水素原子の電子配置を図2-1に示します。
単独水素原子は(a)水素ラジカル、(b)水素+イオン、(c)水素-イオンの3通りの 電子配置の状態が存在します。
(a)水素ラジカルは2個の1s電子席に対して1個だけ電子が収まっています。 この様な条件において、電子の収まっていない電子席は不安定な状態となります。 電子席と電子席の反発よりも電子席と電子の引力の方が強く、2個の電子席は接近します。 この状態は不安定で他の原子とただちに反応します。
(b)水素+イオンは2個の1s電子席に対して両方とも電子が収まっていない状態です。 この様な条件において、電子席と電子席は反発し離れます。 原子全体としてはマイナス電荷が不足するためプラスイオンとなります。 プラスイオンはマイナスイオンと反応して安定状態となります。
(c)水素-イオンは2個の1s電子席に対して両方とも電子が収まっている状態です。 この様な条件において、電子と電子は反発し離れます。 原子全体としてはマイナス電荷が過剰となるためマイナスイオンとなります。 マイナスイオンはプラスイオンと反応して安定状態となります。
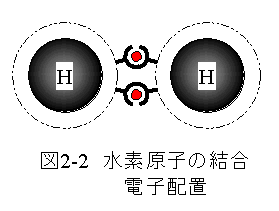
結合電子配置を図2-2に示します。
この状態で安定な水素ガスとなります。 最外周の電子席は2個のみであり、水素原子どうしの結合においては 安定条件はこの条件のみです。
分子式はH2となります。 分子式では原子の数はわかりますが、分子構造まではわかりません。
 分子構造図を図2-3に示します。
分子構造図を図2-3に示します。分子構造図では、1対の共有結合を1本の実線で示します。 これにより原子と原子の結合がわかります。
電子配置図が最も丁寧な表現方法ですが、より複雑な図となります。 特殊な結合を理解するには電子配置図が必要となります。