水は酸素と水素の化合物であり、生命の維持に不可欠な物質です。
水は常温では液体、0℃以下で固体、100℃以上で気体に変化します。
液体の水は、ブドウ糖等を良く溶解します。 また、食塩等の塩類も良く溶解します。 さらには、酢酸等の酸類も溶解し、カセイソ−ダ等のアルカリ類も良く溶解します。 油とはよく混ざりませんが洗剤をいれると乳化することもできます。
この様な水の性質がどこからくるのか?
分子構造にさかのぼって考えてみたいと思います。
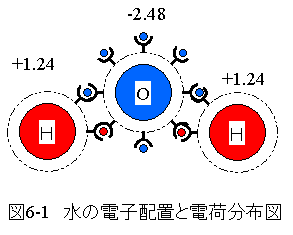
水分子の電子配置を図6-1に示します。
水の分子式は H2O です。
Hの電気陰性度は2.2、Oは3.44です。HとOの電気陰性度の差分 で電荷分布が発生します。
電荷分布のことを「極性」、「分極」とも言います。
このことから「水」は「極性溶剤」の一種と言えます。
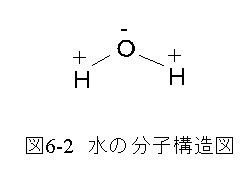
水の分子構造図を図6-2に示します。
(この方が表示が簡単です!!)
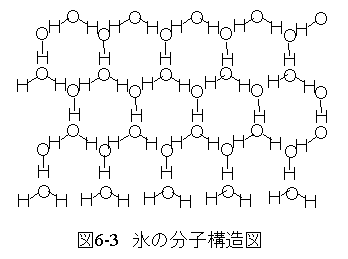
水の結晶(氷)を図6-3に示します。
マイナスの電荷を持つOとプラスの電荷を持つHの引力で 結晶となります。雪は水が結晶化したものです。
温度が0℃以上になると分子運動のため液体にかわります。
温度が100℃以上になると分子運動がさらにさかんになり気体となります。
水は、ブドウ糖等を良く溶解します。 また、食塩等の塩類も良く溶解します。 さらには、酢酸等の酸類も溶解し、カセイソ−ダ等のアルカリ類も良く溶解します。
これらの性質は水の電荷分布(極性)により、イオン等の電荷を持つ物質を 吸引する性質から発生しします。
水は分子運動エネルギー(熱エネルギー)によりプラスHイオンと マイマスOHイオンに分離します。

図6-4にフェルミーディラック分布関数を示します。
フェルミーディラック分布関数の式の誘導は「半導体物理」を 参照願います。
水の分子がプラスHイオンとマイマスOHイオンに分離する 禁制帯エネルギーは0.52eV程度と思われます。
Kはボルツマン定数で1.38E-23 J/degです。 任意の温度における分離粒子発生確率は 図6-4のフェルミーディラック分布関数から求めることが できます。
計算結果を図6-5に示します。
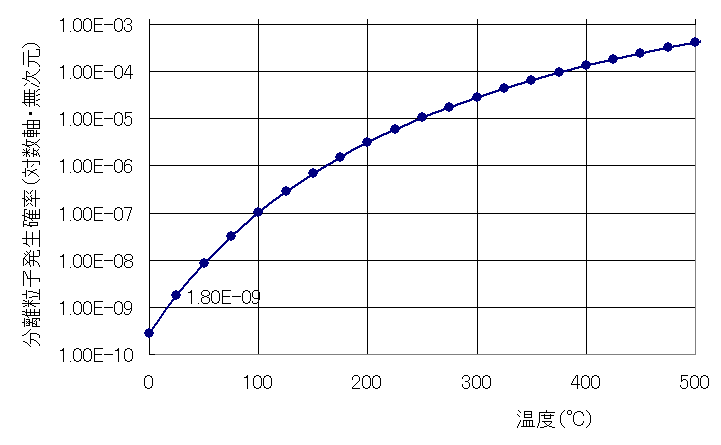
25℃における水の分離粒子発生確率は約1.8E-9程度です。
分離粒子は導電性ですので、純水でも僅かに電気を通します。
イオン性の不純物が溶解しますと溶解したイオンのため電気抵抗が 低下します。一般的な水はイオン性の不純物が溶解していますので 良く電気を通します。このため、感電には注意が必要です。
25 ℃ の純水の場合ほぼ pH=7(中性)となる。
これは中性の時、水素プラスイオン濃度が
1×10-7 mol/l
であることを示しています。
さて、水 1mol の質量は19gです。
水 1 l の質量は1000gです。
従って、水素プラスイオン発生率は
1×10-7×19/1000=1.9×10-9
となります。
ヘェルミーディラック分布関数から求めた分離粒子発生確率と ほぼ一致します。
水素イオン濃度の法則として、
水素プラスイオン濃度 × OHマイナスイオン濃度 =1×10-14
の関係が成立します。
この法則は「半導体物理」でのpn積一定の法則と似ています。
中性が最もイオン数が少なく、酸性またはアルカリ性が強くなるほどイオン数が増大します。