二酸化炭素は地球温暖化の原因として嫌われていますが、 生命の構成に不可欠な物質です。
常温常圧では無色無臭の気体。常圧では液体にならず、-79 ℃ で昇華して固体(ドライアイス)となる。水に比較的よく溶け、水溶液(炭酸)は弱酸性を示す。
この様な性質がどこからくるのか?
分子構造にさかのぼって考えてみたいと思います。
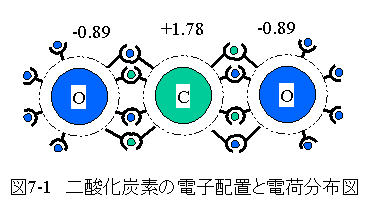
二酸化炭素の性質の電子配置を図7-1に示します。
二酸化炭素の分子式は CO2 です。
炭素の電気陰性度は2.55、酸素は3.44です。炭素と酸素の電気陰性度の差分 で電荷分布が発生します。
電荷分布(極性)は水と比較してやや弱くなります。

二酸化炭素の分子構造図を図7-2に示します。
二酸化炭素は水に良く溶解します。 これは、二酸化炭素が電荷分布(極性)を持つため水の電荷分布(極性) により吸引されるためと思われます。
二酸化炭素が水に溶けると一部は炭酸に変化します。
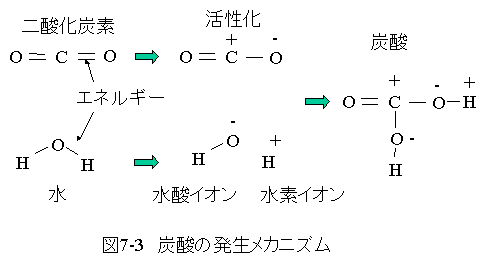
二酸化炭素が炭酸に変化する過程を図7-3にに示します。
二酸化炭素にエネルギーが加わると4本の共有結合のうち1本が切れます。 このとき、電気陰性度の関係で炭素の電子が酸素にもぎ取られます。
従って、炭素はプラス、酸素はマイナスに帯電します。
水にエネルギーが加わると2本の共有結合のうち1本が切れます。 このとき、電気陰性度の関係で水素の電子が酸素にもぎ取られます。
従って、マイナスの水酸イオンとプラスの水素イオンができます。
二酸化炭素の酸素に水素イオンが結合し、炭素に水酸イオンが結合 すると炭酸になります。
炭酸は酸性を示します。
これは、中央の炭素がプラスに帯電し、酸素がマイナスに帯電するため 炭素と酸素の引力が強く、酸素と水素の間で分離するためです。
酸素と水素が分離するとき、水素の電子がもぎ取られプラスの水素イオン となります。プラスの水素イオンが多くなると酸性を示します。