鉄鋼は機械的強度に優れた機械材料です。しかし、唯一の欠点として錆びやすいという特性があります。こ の欠点を補う方法としてメッキがあります。
鉄が錆びるのは誰もが知っている事実です。しかし、鉄がなぜ錆びるのか?どの様に錆びるのか?明快 な説明が非常に難しいことに気づきます。
有機化合物は、水素、炭素、酸素、窒素、フッ素等比較的原子量の小さな元素で構成されています。原子 量の小さな元素は選択できる結合条件が限られており、化合物の分子構造の予測が可能です。
これに対して、原子量が大きくなると、選択できる結合条件の種類が増えます。このため、化合物の分子 構造の予測が困難になります。
鉄(Fe)は化合物の分子構造の予測が困難な例に相当します。
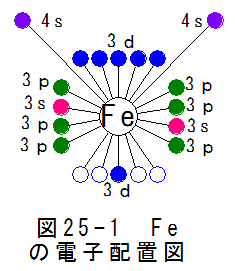
- 鉄(Fe)の電子配置
図25-1に鉄(Fe)の電子配置図を示します。図25-1から、予想される鉄の性質は
(a)4sにある2個を自由電子として放出する。
(b)3dにある4個の空席を埋めようとする作用が働く。
・空席を埋める作用としては、共有結合と配置結合があります。
・共有結合は強い結合で優先されます。
・配置結合は弱い結合で、共有結合で余りが生じた場合に生じると考えられます。
従って、鉄は2個の自由電子の放出と4個の共有結合が同時に生じると考えられます。ダイヤモンドは炭素が4個の 共有結合をした構造で非常に硬くなります。これは、4個の共有結合は強固な立体構造を形成しやすいことを意味します。
鉄が優れた機械強度を持つのは、 4個の共有結合が起因していると考えられます。
以上の条件を満足する鉄の化合物の分子構造を考えた場合、特定の分子式(成分比)を満足する分子構造が無限に存 在し、分子構造が特定できないという問題が生じます。
鉄の酸化化合物としては、FeO、Fe3O4、Fe2O3、Fe(OH)2、Fe(OH)3、FeOOH 等約16種類が知られています。また、空気 中の炭酸と反応して、炭酸鉄 (FeCO3)となります。これらの鉄化合物は分子式として表現されますが、分子構造が特定できません。
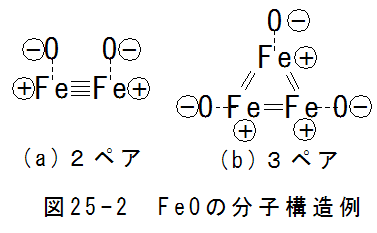
- 鉄化合物FeOの分子構造
まずは、最も単純な鉄化合物FeOで、安定条件を満足する分子構造を考えてみたいと思います。
図25-2にFeOの分子構造例を示します。(a)は2ペアの場合です。この場合、2個のFe原子は4重結合で共有結合4個の 条件を満足します。酸素は自由電子を奪ってマイナスイオンとなります。(b)は3ペアの場合です。この場合、3個のFe原子 は2重結合で共有結合4個の条件を満足します。
4重結合や2重結合は不安定で通常は1重結合となります。(a)(b)は説明上の仮想構造です。実際には4個の1重結合 となるはずです。4個の共有結合は、強固な立体構造を形成するため、Feの立体構造は変化しないことになります。
鉄化合物FeOはFeの最表面のみで発生し、Feの内部には進行しないことになります。
従って、鉄化合物FeOは鉄の錆の要因となりません。
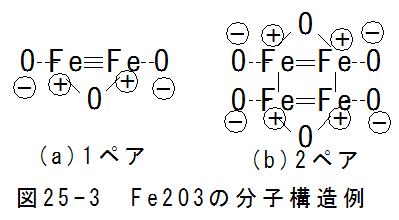
- 鉄化合物Fe2O3の分子構造
鉄化合物Fe2O3は赤錆と呼ばれる化合物です。
図25-3にFe2O3の分子構造例を示します。 (a)は1ペアの場合です。この場合、2個のFe原子は3重結合で共有結合4個の 条件を満足します。 (b)は2ペアの場合です。この場合、4個のFe原子は2重結合で共有結合4個の条件を満足します。
3重結合や2重結合は不安定で通常は1重結合となります。(a)(b)は説明上の仮想構造です。実際には、この分子は3個 の共有結合で結合することになりますが、 3個の共有結合は面(2次元)構造を形成します。
もともと、鉄は4個の共有による3次元構造ですが、鉄化合物Fe2O3に変化すると面(2次元)構造に変化することになります。
面(2次元)構造の物体は剥がれやすく隙間の多い構造となり、表面は隙間だらけとなるはずです。鉄化合物Fe2O3の 膜は隙間が多いため、保護膜を形成できずどこまでも錆が進行することになります。
鉄化合物Fe2O3(赤錆)は鉄の錆の主原因といえます。共有結合が4個から3個に変化するのは、鉄固有の特性であり、 多くの金属はこのような性質はありません。
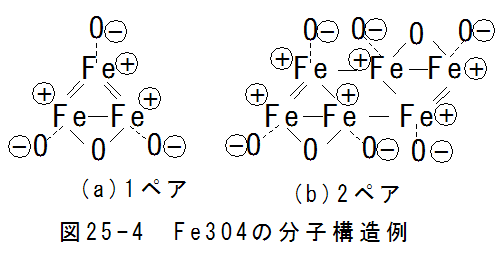
- 鉄化合物Fe3O4の分子構造
鉄化合物Fe3O4は黒錆と呼ばれる化合物です。
図25-4にFe3O4の分子構造例を示します。 (a)は1ペアの場合です。この場合、3個のFe原子は2重結合で共有結合4個の 条件を満足します。 (b)は2ペアの場合です。
2重結合は不安定で通常は1重結合となります。(a)(b)は説明上の仮想構造です。実際には、この分子は2個の共有結合で 結合することになりますが、 2個の共有結合は線(1次元)構造を形成します。
もともと、鉄は4個の共有による3次元構造ですが、鉄化合物Fe3O4に変化すると線(1次元)構造に変化することになります。
線(1次元)構造の物体は柔軟性があり、しなやかな構造体となります。しなやかな構造体のため、隙間の少ない緻密な膜を形 成することになります。
緻密な膜は保護膜として作用するため、錆が内部深くまで進行することはありません。
鉄化合物Fe3O4の膜は保護膜として作用するため、鉄の錆の主原因とはなりません。しかし、鉄化合物Fe3O4の膜は安定 な膜ではなく、防錆性はあまりよくありません。
- その他腐食性鉄化合物
鉄化合物Fe2O3以外の腐食性化合物としては、 Fe(OH)3、FeOOH 等が考えられます。これらは、 Fe2O3同様に面(2次 元)構造体となります。
- 鉄の腐食対策
内部深くまで錆が進行する特性を持つ金属は鉄ですが、多くの金属は表面に保護膜を形成するため内部深くまで錆が進行 することはありません。
したがって、鉄の表面を鉄以外の金属で包んでしまえば、腐食を防止できることになります。この方法のひとつとしてメッキ処 理があります。
亜鉛メッキは、トタン等屋外に設置する鉄構造物によく用いられます。
- 亜鉛の電子配置
図24-10にZnの電子配置図を示します。図24-10において、第1軌道、第2軌道、第3軌道は電子で満たされており、記載を省略 しています。第4軌道は4sに2個の電子が満たされています。4pは6個全て空席、4dは10個全て空席、4fは14個全て空席です。空 席の記載は省略しています。
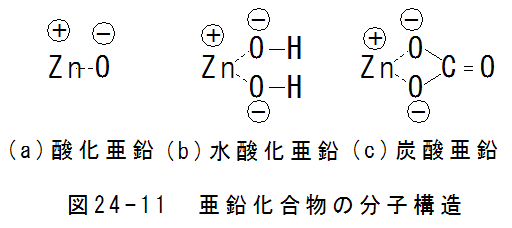
- 亜鉛化合物
図24-10から亜鉛は、2個の自由電子を放出して安定し、共有結合が起こらないことが予測できます。このため、亜鉛化合物の 分子構造は単純な構造となります。空気中には、活性酸素、水酸、炭酸等が微量ですが含まれています。亜鉛はこれらの物質 と反応して、亜鉛化合物を生成します。
図24-11の亜鉛化合物の分子構造を示します。いずれの化合物も単純なイオン結合の化合物となります。これらはいずれも 亜鉛の表面に緻密な保護膜を形成するため、錆が内部に進行することはありません。
- 溶融亜鉛メッキの規格
溶融亜鉛めっきに関する日本工業規格に関しては
● JIS H 8641 溶融亜鉛めっき
● JIS H 0401 溶融亜鉛めっき試験方法
があります。
適用としては
1種A 厚さ5mm以下の鋼材・鋼製品、鋼管類及び鋳鍛造品類。
1種B 厚さ5mmを超える鋼材・鋼製品、鋼管類及び鋳鍛造品類。
2種35 厚さ1mm以上2mm以下の鋼材・鋼製品、直径12mm以上のボルト・ナット及び厚さ2.3mmを超える座金類。
2種40 厚さ2mmを超え3mm以下の鋼材・鋼製品及び鋳鍛造品類。
2種45 厚さ3mmを超え5mm以下の鋼材・鋼製品及び鋳鍛造品類。
2種50 厚さ5mmを超える鋼材・鋼製品及び鋳鍛造品類。
2種55 過酷な腐食環境下で使用される鋼材・鋼製品及び鋳鍛造品類。
・ 2種55 (HDZ 55) のめっきを要求するものは、素材の厚さ6mm以上であることが望ましい。
・過酷な腐食環境は、海塩粒子濃度の高い海岸、凍結防止剤の散布される地域などをいう。
と表現されており、 2種55についてはかなり過酷な条件に適合することがわかります。
具体的なメッキ厚の目安は以下の表のとおりとなります。
溶融亜鉛メッキについては、厚いほど防食性が良いということになります。種 類 記号 付着量g/㎡ 平均めっき膜厚μm 1種A HDZ A ― 28〜42 1種B HDZ B ― 35〜49 2種35 HDZ 35 350以上 49以上 2種40 HDZ 40 400以上 56以上 2種45 HDZ 45 450以上 63以上 2種50 HDZ 50 500以上 69以上 2種55 HDZ 55 550以上 76以上
- 電気亜鉛メッキの規格
電気亜鉛めっきに関する日本工業規格に関しては JIS H8610 があります。
1・適用範囲
この規格は防食の目的で鉄素地に施した電気亜鉛鍍金について規定する
2・種 類
電気亜鉛鍍金の種類は表面処理の方法により2種に分け さらに鍍金の厚さによりそれぞれ6級に分ける
※1種は、鍍金のまま、2種は、鍍金後、クロメート処理を行ったもの種 類 等 級 記 号 種 類 等 級 記 号 平均めっき膜厚μm 1 種 1 級 MFZN 1 2 種 1 級 MFZN 1C 28〜42 1 種 2 級 MFZN 2 2 種 2 級 MFZN 2C 35〜49 1 種 3 級 MFZN 3 2 種 3 級 MFZN 3C 49以上 1 種 4 級 MFZN 4 2 種 4 級 MFZN 4C 56以上 1 種 5 級 MFZN 5 2 種 5 級 MFZN 5C 63以上 1 種 6 級 MFZN 6 2 種 6 級 MFZN 6C 69以上
3・品 質
外 観
鍍金は平滑な微細粒で密着し、焦げ痕・膨れ及び突起があったり、隅に素地が露出 してはならない。表面の色合またはクロメート処理による干渉シマはあってもよい (生地に欠点があって通常の方法では、この欠点が明らかにされないものでも鍍金 することによって、鍍金の欠点のように表れることがある)
鍍金の厚さ
鍍金の厚さは1種・2種に関わらず、等級によって規定する なお、2種の場合はクロメート処理の厚みは含まないものとする
電気亜鉛メッキは溶融亜鉛メッキと比較して、均一な膜厚が得られますが、膜厚は薄めとなります。等 級 記 号 厚 さ 1 級 MFZN 1 ・ 1C 2μ ( 0.002mm )以上 2 級 MFZN 2 ・ 2C 5μ ( 0.005mm )以上 3 級 MFZN 3 ・ 3C 8μ ( 0.008mm )以上 4 級 MFZN 4 ・ 4C 12μ ( 0.012mm )以上 5 級 MFZN 5 ・ 5C 20μ ( 0.020mm )以上 6 級 MFZN 6 ・ 6C 25μ ( 0.025mm )以上
電気亜鉛メッキは圧着端子等の電気部品に良く適用されます。
クロムメッキは高精度の機械部品の防食処理として良く使用します。
- クロムの電子配置
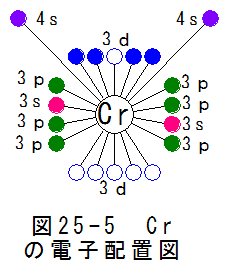
図25-5にクロム(Cr)の電子配置図を示します。図25-5から、予想されるクロムの性質は
(a)4sにある2個を自由電子として放出する。
(b)3dにある6個の空席を埋めようとする作用が働く。
・空席を埋める作用としては、共有結合と配置結合があります。
・共有結合は強い結合で優先されます。
・配置結合は弱い結合で、共有結合で余りが生じた場合に生じると考えられます。
従って、クロムは2個の自由電子の放出と6個の共有結合が同時に生じると考えられます。4個以上の共有結合は強固 な立体構造を形成します。
クロムが優れた機械強度を持つのは、 6個の共有結合が起因していると考えられます。
以上の条件を満足するクロムの化合物の分子構造を考えた場合、特定の分子式(成分比)を満足する分子構造が無限に 存在し、分子構造が特定できないという問題が生じます。
クロムの酸化化合物としては、CrO、Cr2O3、CrO3等が知られています。また、空気中の水酸と反応して、水酸クロム Cr2O(OH)4 となります空気中の炭酸と反応して、炭酸クロム Cr2(CO3)3となります。これらの鉄化合物は分子式として 表現されますが、分子構造が特定できません。
- クロム化合物CrOの分子構造
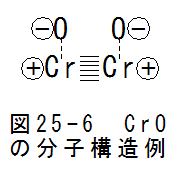
まずは、最も単純なクロム化合物CrOで、安定条件を満足する分子構造を考えてみたいと思います。
図25-6にCrOの分子構造例を示します。図25-6は2ペアの場合です。この場合、2個のCr原子は6重結合で共有結 合6個の条件を満足します。酸素は自由電子を奪ってマイナスイオンとなります。
6重結合は不安定で通常は1重結合となります。図25-6は説明上の仮想構造です。実際には6個の1重結合となる はずです。6個の共有結合は、強固な立体構造を形成し、Crの立体構造は変化しないことになります。
クロム化合物CrOはCrの最表面のみで発生し、Crの内部には進行しないことになります。
ただし、クロム化合物CrOは不安定でCr2O3に変化する性質があります。
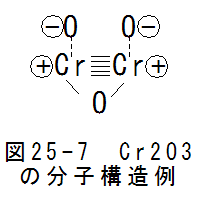
- クロム化合物Cr2O3の分子構造
図25-7にCr2O3の分子構造例を示します。図25-7は1ペアの場合です。この場合、2個のCr原子は5重 結合で共有結合6個の条件を満足します。酸素は自由電子を奪ってマイナスイオンとなります。
5重結合は不安定で通常は1重結合となります。図25-7は説明上の仮想構造です。実際には5個の1重結合となるはず です。5個の共有結合は、強固な立体構造を形成します。
このため、クロム化合物Cr2O3は硬く強い立体構造となります。クロムの表面には、緻密で硬く、強い保護膜は形成さ れます。従って、クロム化合物Cr2O3はCrの最表面のみで発生し、Crの内部には進行しないことになります。
クロム化合物Cr2O3は化学反応的にも安定な膜です。
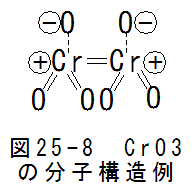
- クロム化合物CrO3の分子構造
図25-8にCrO3の分子構造例を示します。図25-8は2ペアの場合です。この場合、2個のCr原子は2重結合で共有結合6個 の条件を満足します。酸素は自由電子を奪ってマイナスイオンとなります。
2重結合は不安定で通常は1重結合となります。図25-8は説明上の仮想構造です。実際には2個の1重結合となるはず です。2個の共有結合は、線(1次元)構造を形成します。
線(1次元)構造の物体は柔軟性があり、しなやかな構造体となります。しなやかな構造体のため、隙間の少ない緻密な膜 を形成することになります。
緻密な膜は保護膜として作用するため、錆が内部深くまで進行することはありません。
ただし、クロム化合物CrO3は不安定でCr2O3に変化する性質があります。
- その他クロム化合物
その他クロム化合物としては、 Cr2O(OH)4 、 Cr2(CO3)3 等が考えられます。これらは、 Cr2O3同様に5個の共有結合 により強固な立体構造を形成します。
・クロムは硬く、強固な金属です。
・クロム化合物も硬く、強固な物性を持ちます。
- クロムメッキ方法
電気メッキとなります。
- 日本硬質クロム工業会規格の抜粋
4.品質
・めっきの外観は、5‐1によって試験をか、表面は平滑で、焦げ、こぶなど使用上有害な欠陥があってはならない。ただ し、つや消し仕上げ(液体ホーニング、ブラスト仕上げ、ポーラス加工など)のものについては、必ずしも平滑でなくてもよい。
・めっきの最小厚さ及び許容差は、受注当事者間の協定による。
・ポーラスクロムめっきの多孔率については、受注当事者間の協定による。
・めっきの密着性は、5‐4によって試験を行い、めっきのははく離又は膨れがあってはならない。
・めっきの硬さは5‐5によって試験を行い、ビッカース硬さ750以上とする。ただし用途によってはビッカース硬さは受渡 当事者間の協定によってもよい。
・めっきの耐磨耗性は、受注当事者間の協定による。
・めっきの耐食性はこの品質を特に重視する用途に対してだけ適用し、その品質は受注当事者間の協定による。
クロムメッキの膜厚や品質の規格はあいまいですので、個別にきめる必要があります。
- 精密機械部品の防食処理
・はめ合い公差で精密加工した機械部品をメッキすると寸法が変化してしまう問題が生じます。
・かなり昔は、精密機械部品には黒染め( Fe3O4黒錆ともいいます。 )を行っていましたが、黒染めの防食性はあ まりよくありません。
・黒染めに代わる処理として登場したのがレイデント処理です。レイデント処理は商品名であり、具体的には黒色クロ ムメッキで膜厚は1μm以下の薄いメッキ膜です。
・レイデント処理(薄膜黒色クロムメッキ)では、はめ合い公差加工部での寸法変化起因のトラブルは確認されま せんでした。また、黒染めと比較して防食性は向上します。
- 機械部品の耐摩耗性向上処理
・鉄鋼は焼入れ焼き戻しを行ってマルテンサイト化しないと十分な耐摩耗性がえられません。
・硬質クロムメッキを膜厚20μm程度行うと、通常の鉄鋼でも大幅に耐摩耗性が向上します。ただし、メッキ膜厚が大 きいため、メッキ後の加工が必要となります。
・溶着、蒸着、CVD、スパッタ等のコーティング技術を使用すると、クロム以上の耐摩耗性を持つ材料(タングステンカ ーバイト、チタンカーバイト、チタンナイトライド、DLC(ダイヤモンド膜)等)のコーティングが可能です。
- クロムメッキの特徴
・クロムメッキの規格は曖昧でよくわかりません。使用目的により、メッキ仕様が大幅に異なるためと思われます。
・1μm以下の薄膜で十分な強度と防食があります。
・耐摩耗性向上を目的とした場合は、厚めにメッキする必要があります。
ニッケルメッキは装飾用として良く使用します
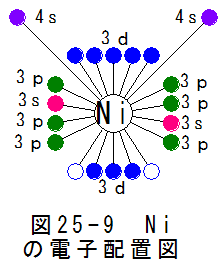
- ニッケルの電子配置
図25-9にニッケル(Ni)の電子配置図を示します。図25-9から、予想されるニッケルの性質は
(a)4sにある2個を自由電子として放出する。
(b)3dにある2個の空席を埋めようとする作用が働く。
・空席を埋める作用としては、共有結合と配置結合があります。
・共有結合は強い結合で優先されます。
・配置結合は弱い結合で、共有結合で余りが生じた場合に生じると考えられます。
従って、ニッケルは2個の自由電子の放出と2個の共有結合が同時に生じると考えられます。2個の共有結合は線 (1次元)結合となり、柔軟でしなやかな構造体となります。
ニッケルは柔らかい特性をもつと思われます。
以上の条件を満足するニッケルの化合物の分子構造を考えた場合、特定の分子式(成分比)を満足する分子構造 が無限に存在し、分子構造が特定できないという問題が生じます。
ニッケルの酸化化合物としては、NiOが唯一確認されています。理論上存在しうる酸化物としてはNi2O3があります。
また、空気中の水酸と反応して、水酸ニッケルNi(OH)2 となります。空気中の炭酸と反応して、炭酸ニッケル NiCO3となります。
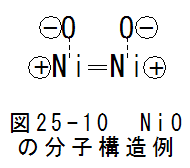
- ニッケル化合物NiOの分子構造
図25-10にNiOの分子構造例を示します。図25-10は2ペアの場合です。この場合、2個のNi原子は2重結合で共有結合2個の条 件を満足します。酸素は自由電子を奪ってマイナスイオンとなります。
2重結合は不安定で通常は1重結合となります。図25-10は説明上の仮想構造です。実際には2個の1重結合となるはずです
。 2個の共有結合は、線(1次元)構造を形成します。線(1次元)構造の物体は柔軟性があり、しなやかな構造体となります。しなや かな構造体のため、隙間の少ない緻密な膜を形成することになります。
緻密な膜は保護膜として作用するため、錆が内部深くまで進行することはありません。
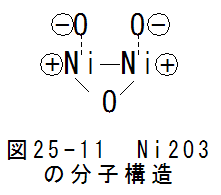
- ニッケル化合物Ni2O3の分子構造
図25-11にNi2O3の分子構造例を示します。図25-7は1ペアの場合です。この場合、2個のNi原子は1重結合で共有結 合2個の条件を満足します。酸素は自由電子を奪ってマイナスイオンとなります。
従って、分子構造は確定し、変化の余地がなくなります。この分子構造は、配置結合もできませんので分子間の結合 は、分極による引力のみで弱く、液体のような特性になるかもしれません。具体的には確認されていない化合物です。
- その他ニッケル化合物
その他ニッケル化合物としては、 Ni(OH)2 、 NiCO3等が考えられます。これらは、 NiO同様に2個の共有結合 により線(1次元)構造を形成します。
・ニッケルはしなやかで柔軟性のある金属です。
・ニッケル化合物もしなやかで柔軟性のある物性を持ちます。
- ニッケルメッキ方法
・電気メッキと無電解メッキがあります。
・電気メッキは下地材料が導電性でなければなりません。
・無電解メッキは下地材料が導電性はもちろん可能ですが、ガラス、プラスチック等非導電性材料にもメッキすることができます。
- JIS H 8617-1990の抜粋
・電気メッキの規格
・下地が鉄の場合のニッケルメッキの等級・記号・膜厚
等級 記号 膜厚(μm)
1級 MFNi Ⅰ 3以上
2級 MFNi Ⅱ 5以上
3級 MFNi Ⅲ 10以上
4級 MFNi Ⅳ 15以上
5級 MFNi Ⅴ 20以上
- ニッケルメッキの適用事例
・ニッケルメッキの外観は美しいので、外観を重視する場合に適用します。この場合、通常電気メッキを使用します。
・大型の精密ベース等には、無電解ニッケルメッキを適用します。無電解ニッケルメッキでは、メッキ膜厚を薄めに指定します。
・ガラス、プラスチック等非導電性材料にメッキする場合は、無電解ニッケルメッキ後電気メッキで厚さを厚くします。
- ニッケルメッキの特徴
・ニッケルメッキの規格も曖昧でよくわかりません。使用目的により、仕様が大幅に異なるためと思われます。
・美しい外観に仕上がります。
・耐摩耗性はクロムメッキと比較して劣ります。
素材はアルミの場合は、通常アルマイト処理を行います。アルミは通常雰囲気において腐食しないため、防食処理は不要 ですが、柔らかくキズがつきやすいため、アルマイト処理をおこなって表面を硬くします。また色を付けることが可能ですが、通 常黒を用います。
- アルミの電子配置
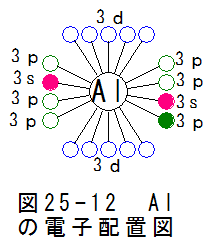
図25-12にアルミ(Al)の電子配置図を示します。図25-12から、予想されるアルミの性質は
(a) 3pにある5個の空席を埋めようとする作用が働く。
・空席を埋める作用としては、共有結合と配置結合があります。
・共有結合は強い結合で優先されます。
・配置結合は弱い結合で、共有結合で余りが生じた場合に生じると考えられます。
従って、アルミは3個の共有結合と2個の配置結合で安定状態となります。
また、3dには10個の空席があり、最大12個の配置結合が可能です。
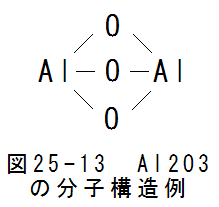
- アルミ化合物Al2O3の分子構造
図25-13にAl2O3の分子構造例を示します。この場合、結合は全て1重で安定状態です。
図25-13からは判断できないのですが、 Al2O3分子は3個の酸素側に配置結合可能な電子が合計18個あります。2個のアルミ 側には、配置結合可能な空席が合計24個あります。
Al2O3分子は安定状態を保とうとして、配置結合するはずです。上記の条件から18個の配置結合した状態が最も安定 です。配置結合は共有結合と比較して、弱い結合ですが、たくさん結合すると強くなります。この特性から、 Al2O3分子は 硬く強固な物性をもつことになります。また、Al2O3分子が結晶化するとサファイア、ルビー等になります。
- アルマイト処理の注意点
アルマイト処理は表面を硬くするため、通常アルマイト層が20〜30μmになるように実施されます。このため、はめ合 い公差で加工した面は寸法誤差が生じます。
はめ合い公差部分の加工は、アルマイト処理後に実施しないと寸法誤差起因のトラブルが発生します。
- 鉄鋼は優れた機械材料ですが、錆びやすい欠点があります。この欠点を補う方法としては、メッキがベストです。
- メッキの種類は使用目的により、亜鉛メッキ、クロムメッキ、ニッケルメッキ等を使い分ける必要があります。
- アルミは軽量化に適した材料です。しかし、柔らかく表面にキズがつきやすいため、表面を硬くするアルマイト処理を推奨しま
す。ただし、はめ合い公差部分の加工は、アルマイト処理後に実施しないと寸法誤差起因のトラブルが発生します。
- ステンレス鋼(SUS304を推奨)を使用すると、メッキ処理が不要となります。小物で少量の場合、ステンレス鋼が有利と
なることがあります。
- 全ての金属に共通する欠点ですが、酸に弱い特性があります。また、電解質中では、電流が発生して電解腐食す
ることがあります。このような条件下では、絶縁性の材料(プラスチック、セラミック、ガラス等)を使用する必要があります。