異なる材質の金属を導線でつなぐと電位差が生じます。この状態で電解質中につけると電解腐食が発生し ます。金属のイオン化傾向と電解腐食の関係について検討してみたいと思います。
異なる材質の金属を導線でつなぐと電位差が生じるわけですが、電位の基準を標準水素電極と定めているようで す。標準電極電位は各元素ごとに実測が可能ですが、なぜ?電位差が生じるのか?推論してみたいと思います。
各種金属の標準電極電位を小さい順に並べて表にすると以下のようになります。
表26-1 各種金属の標準電極電位
| 元素名 | 記号 | 標準電極電位 | 自由電子軌道 | 原子番号 | 原子量 | 密度 | 原子半径 | 共有結合半径 | イオン化エネルギ |
| 単位 | - | (V) | - | - | g/mol | g/cm^3 | pm | pm | kJ/mol |
| リチウム | (Li), | -3.045 | 2s | 3 | 6.941 | 0.534 | 152 | 128 | 520.2 |
| カリウム | (K), | -2.925 | 4s | 19 | 39.1 | 0.862 | 227 | 203 | 418.8 |
| ルビジウム | (Rb), | -2.924 | 5s | 37 | 85.5 | 1.53 | 248 | 220 | 403 |
| セシウム | (Cs), | -2.923 | 6s | 55 | 132.9 | 1.93 | 265 | 244 | 375.7 |
| バリウム | (Ba), | -2.92 | 6s | 56 | 137.3 | 3.51 | 222 | 215 | 502.9 |
| ストロンチウム | (Sr), | -2.89 | 5s | 38 | 87.6 | 2.64 | 215 | 195 | 549.5 |
| カルシウム | (Ca), | -2.84 | 4s | 20 | 40.1 | 1.55 | 197 | 176 | 589.8 |
| ナトリウム | (Na), | -2.714 | 3s | 11 | 22.99 | 0.968 | 186 | 166 | 495.8 |
| マグネシウム | (Mg), | -2.356 | 3s | 12 | 24.3 | 1.74 | 160 | 141 | 737.7 |
| トリウム | (Th), | -1.9 | 7s | 90 | 232 | 11.7 | 179 | 206 | 587 |
| ベリリウム | (Be), | -1.85 | 2s | 4 | 9 | 1.85 | 112 | 96 | 899.5 |
| アルミニウム | (Al), | -1.676 | 3p | 13 | 27 | 2.7 | 143 | 121 | 577.5 |
| チタン | (Ti), | -1.63 | 4s | 22 | 47.9 | 4.5 | 147 | 160 | 658.8 |
| ジルコニウム | (Zr), | -1.534 | 5s | 40 | 91.2 | 6.52 | 160 | 175 | 640.1 |
| マンガン | (Mn), | -1.18 | 4s | 25 | 54.9 | 7.2 | 127 | 139 | 717.3 |
| タンタル | (Ta), | -0.81 | 6s | 73 | 180.9 | 16.7 | 146 | 170 | 761 |
| 亜鉛 | (Zn), | -0.7626 | 4s | 30 | 65.4 | 7.14 | 134 | 122 | 906.4 |
| クロム | (Cr), | -0.74 | 4s | 24 | 52 | 7.19 | 128 | 139 | 652.9 |
| 鉄 | (Fe), | -0.44 | 4s | 26 | 55.8 | 7.87 | 126 | 132 | 762.5 |
| カドミウム | (Cd), | -0.4025 | 5s | 48 | 112.4 | 8.65 | 151 | 144 | 867.8 |
| コバルト | (Co), | -0.277 | 4s | 27 | 58.9 | 8.9 | 125 | 126 | 760 |
| ニッケル | (Ni), | -0.257 | 4s | 28 | 58.7 | 8.9 | 124 | 124 | 737.1 |
| スズ | (Sn), | -0.1375 | 5p | 50 | 118.7 | 7.4 | 140 | 139 | 708.6 |
| 鉛 | (Pb), | -0.1263 | 6p | 82 | 207.2 | 11.34 | 175 | 146 | 715.6 |
| アンチモン | (Sb), | 0.1504 | 5p | 51 | 121.8 | 6.7 | 140 | 139 | 834 |
| ビスマス | (Bi), | 0.3172 | 6p | 83 | 209 | 9.78 | 156 | 148 | 703 |
| 銅 | (Cu), | 0.34 | 4s | 29 | 63.5 | 8.94 | 128 | 132 | 745 |
| 水銀 | (Hg), | 0.796 | 6s | 80 | 200.6 | 13.5 | 151 | 132 | 1007.1 |
| 銀 | (Ag), | 0.7991 | 5s | 47 | 107.9 | 10.5 | 144 | 145 | 731 |
| パラジウム | (Pd), | 0.915 | 5s | 46 | 106.4 | 12 | 137 | 139 | 804.4 |
| イリジウム | (Ir), | 1.156 | 6s | 77 | 192.2 | 22.6 | 136 | 141 | 880 |
| 白金 | (Pt), | 1.188 | 6s | 78 | 195.1 | 21.45 | 139 | 136 | 870 |
| 金 | (Au), | 1.52 | 6s | 79 | 197 | 19.3 | 144 | 136 | 890 |
上記の表は、自由電子軌道が2sから7sまで混在しており、おなじ条件で比較できないため、自由電子軌道が4sの元 素のみの表にすると下記の様になります。
表26-2 自由電子軌道が4sの金属の標準電極電位
| 元素名 | 記号 | 標準電極電位 | 自由電子軌道 | 原子番号 | 原子量 | 密度 | 原子半径 | 共有結合半径 | イオン化エネルギ |
| 単位 | - | (V) | - | - | g/mol | g/cm^3 | pm | pm | kJ/mol |
| カリウム | (K), | -2.925 | 4s | 19 | 39.1 | 0.862 | 227 | 203 | 418.8 |
| カルシウム | (Ca), | -2.84 | 4s | 20 | 40.1 | 1.55 | 197 | 176 | 589.8 |
| チタン | (Ti), | -1.63 | 4s | 22 | 47.9 | 4.5 | 147 | 160 | 658.8 |
| マンガン | (Mn), | -1.18 | 4s | 25 | 54.9 | 7.2 | 127 | 139 | 717.3 |
| 亜鉛 | (Zn), | -0.7626 | 4s | 30 | 65.4 | 7.14 | 134 | 122 | 906.4 |
| クロム | (Cr), | -0.74 | 4s | 24 | 52 | 7.19 | 128 | 139 | 652.9 |
| 鉄 | (Fe), | -0.44 | 4s | 26 | 55.8 | 7.87 | 126 | 132 | 762.5 |
| コバルト | (Co), | -0.277 | 4s | 27 | 58.9 | 8.9 | 125 | 126 | 760 |
| ニッケル | (Ni), | -0.257 | 4s | 28 | 58.7 | 8.9 | 124 | 124 | 737.1 |
| 銅 | (Cu), | 0.34 | 4s | 29 | 63.5 | 8.94 | 128 | 132 | 745 |
表26-2の自由電子軌道が4sの金属の標準電極電位において、標準電極電位と密度の相関がありそうです。グラフに してみましょう。
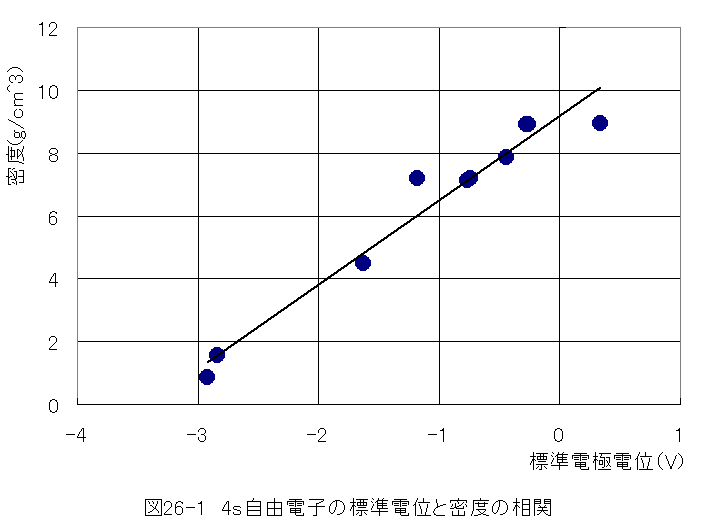
図26-1において、標準電極電位と密度は近似的ですが直線的な相関がありそうです。現象を理解するた め簡単なモデルを考えてみましょう。
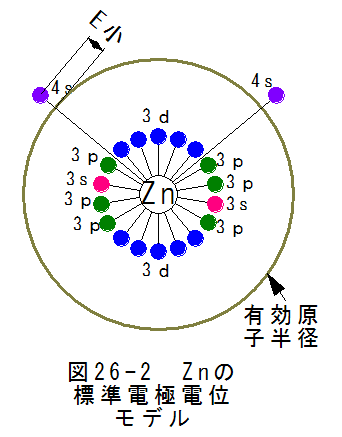 (1)亜鉛(Zn)の標準電極電位モデル
(1)亜鉛(Zn)の標準電極電位モデル図26-2に亜鉛(Zn)の標準電極電位モデルを示します。亜鉛は密度が小さいのですが、これを有効電子半径が大きいと します。有効原子半径は軌道4sのすぐ下の電位にあるとします。原子が密集した場合、有効原子半径より外側の軌道は 消滅し電子を保持できないとします。すると電子は自由電子となり自由に動きだしますが、電位は有効原子半径の電位 になるはずです。
ここで、亜鉛の密度がなぜ小さくなるかは説明できないのですが、亜鉛が軽いのは事実です。なぜでしょうか?
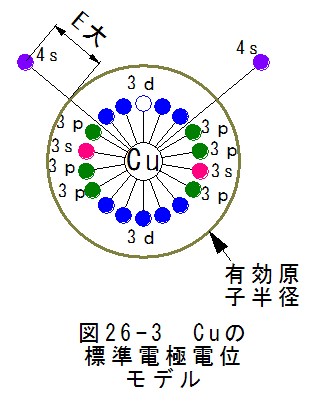 (2)銅(Cu)の標準電極電位モデル
(2)銅(Cu)の標準電極電位モデル図26-3に銅(Cu)の標準電極電位モデルを示します。銅は密度が大きいのですが、これを有効電子半径が小さ いとします。有効原子半径は軌道4sのかなり下の電位にあるとします。原子が密集した場合、有効原子半径より外側 の軌道は消滅し電子を保持できないとします。すると電子は自由電子となり自由に動きだしますが、電位は有効原子 半径の電位になるはずです。
亜鉛の有効電子半径の電位と銅の有効電子半径の電位が異なるため、亜鉛と銅では電位差が生じるはずです。 このモデルでは、有効原子半径という仮想モデルを設定しています。これにより異なる金属間で電位差が生じる 説明が可能となります。
しかし、どのようなメカニズムで有効原子半径が決定されるかはわかりません。
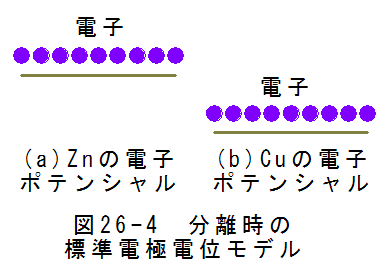
亜鉛と銅が分離した状態を図にすると、図26-4に示すようになります。図26-4において、標準電極電位の値とポテン シャルが逆転していることに注意しましょう。亜鉛は標準電極電位が小さいのですが、このとき自由電子のポテンシャ ルは高くなります。また、銅の標準電極電位が大きいのですが、自由電子のポテンシャルは低くなります。逆転が起こ るのは電流はプラスからマイナスに流れると定義されていますが、電子はマイナスからプラスに流れるためです。
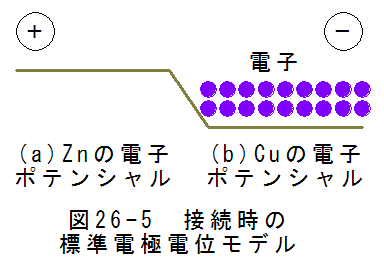 亜鉛と銅を接続すると、図26-5に示すようになります。電子はポテンシャル差により、銅側に移動します。これにより
、亜鉛側がプラス、銅側がマイナスに帯電することになります。
亜鉛と銅を接続すると、図26-5に示すようになります。電子はポテンシャル差により、銅側に移動します。これにより
、亜鉛側がプラス、銅側がマイナスに帯電することになります。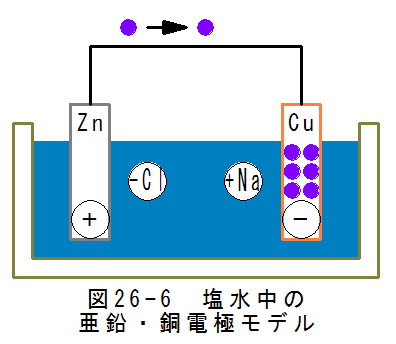
電解質はさまざまな種類がありますが、ここでは塩水に漬けた場合を考えてみたいと思います。
図26-6に塩水中の亜鉛・銅電極のモデルを示します。亜鉛電極から銅電極に向かって電子が流れるため、亜鉛電極が マイナス電極、銅電極がプラス電極となります。
亜鉛電極はプラスに帯電するため、マイマスの塩素イオンが集まります。亜鉛はプラスに帯電し、塩素イオンからの引力 が作用して
Zn → (+Zn) + 2e
の反応が発生します。
(+Zn)はプラス亜鉛イオンの意味であり、溶液中に溶解します。
2eは2個の電子の意味であり、導線を経由して銅電極に流れます。
銅電極はマイナスに帯電するため、プラスのナトリウムイオンが集まります。銅には余剰の電子があり、余剰電子が反応して
(+Na) + e → Na
の反応が起こるはずです。
しかし、金属ナトリウムは、ただちに以下の反応を起こします。
Na + H2O → (+Na) + (-OH) + H2/2
上記の反応式において、Naは金属ナトリウム、H2Oは水です。 (+Na)はプラスナトリウムイオンであり、 (-OH)は水酸イオン 、 H2/2は水素ガスの半分を意味します。
トータルの変化としては
Zn + 2(H2O) → (+Zn) + 2e + 2 (-OH) + H2
の変化が起こることになります。
亜鉛と銅の電位差は約1.1ボルトであり、2個の電子は約2.2eVエネルギーを発生したことになります。
上記の反応の結果、銅電極のまわりは水素ガスで覆われて絶縁されることになります。絶縁されると反応はとまり ますが、水素ガスが集まって泡となり上昇すると反応は再開されます。
電解質は水が減少し、亜鉛イオンと水酸イオンが増加することになります。
以上、塩水中の亜鉛と銅電極を例にとって電解腐食の反応原理を説明しました。しかし、この原理は、あらゆる金属の組合 せ、電解質の組合せに適合します。
電解質中で使用する機械部品の材質に何を選択すべきか?この課題は大いなる悩みです。通常の使用環境であれば、ス テンレス鋼SUS304をを選択するでしょう。
また、ステンレス鋼SUS304より耐食性が改善されたSUS316やSUS3160Lも選択子です。 SUS316やSUS3160Lは電解腐食 をおこなさないのでしょうか?あまり、明確な根拠はありません。
樹脂、ガラス、セラミック等は絶縁体であり、原理的に電解腐食は発生しません。しかし、残念なことにステンレス鋼に匹敵 する強度がありません。
ネジ、ナット等固定部品には大きな応力がかかるため、金属が望ましいのです。
やもえない場合は、ステンレス鋼のネジ、ナット等で組立て後塗装処理をして、表面を絶縁する方法が考えられます。 この場合、分解、再組立てを行うと塗装膜が破壊されますので、再塗装が必要となります。
なにか、良い対策方法があればよいのですが?
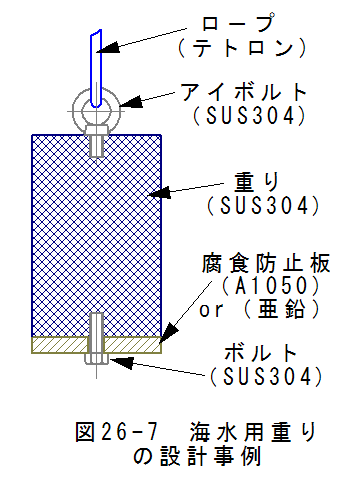
海で使用する重りの設計事例を図26-7に示します。海水中では鉄は錆びやすいためステンレス鋼SUS304を使用しま す。ステンレス鋼SUS304は鉄、クロム、ニッケルの合金であり、必ずしも均一な組成とはかぎりません。これは、オーステ ナイト組織は加工歪等の影響により、部分的にマルテンサイトに変化することがあるためです。
また、アイボルトもSUS304を使用しますが、厳密に組成が一致するわけではありません。
厳密には、電解腐食が発生する可能性があります。図26-7に示す設計事例では、電解腐食防止板を取り付けること で、重りとアイボルトの電解腐食を防止します。
電解腐食防止板の材質は純アルミ(A1050)または亜鉛を選定します。こうすると重りとアイボルトはマイナスに帯電し、 電解腐食防止板がプラスに帯電します。電解腐食防止板が電解腐食しわずかに溶け出しますが、重りとアイボルトはア ルミまたは亜鉛のイオンに保護され腐食は進行しません。
長期的にみれば、電解腐食防止板のみが保守用交換部品となります。電解腐食防止板の形状を簡単にしておけば、 交換部品のコストは大幅に低減できることになります。
本設計事例は、電解腐食の原理を巧みに逆用した対策であり、試す価値があると思っています。