乾電池は普段手軽に使用していますが、その動作原理を理解しようとすると、難しいことに気づきます。ここで は、乾電池の構造と動作原理について検討してみたいと思います。
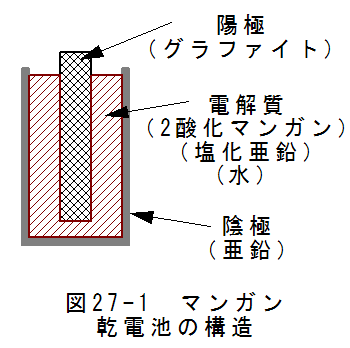
マンガン乾電池は、古くからある乾電池で単1、単2、単3等のサイズがあります。
- マンガン乾電池の構造
図27-1にマンガン乾電池の基本構造を示します。円筒状の亜鉛容器が陰極となります。中央に炭素棒(グラファイト) がありこれが陽極となります。
陰極と陽極の間には2酸化マンガン、塩化亜鉛、水の混合物で構成される電解質が詰められています。
これで電池となるわけですが、反応原理を理解するのは、意外と難しいことに気づきます。
- グラファイトの物性
グラファイトの物性はとても変わっています。
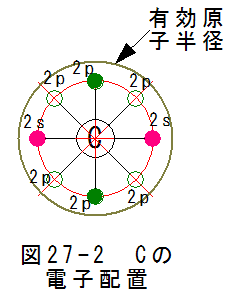
図27-2に炭素の電子配置を示します。軌道2sに2個の電子があり、2pに2個の電子があり、2pに4個の空席があります。
従って、炭素は4個の共有結合で安定状態となります。有効原子半径は通常の結合において、軌道2pの外側にあると思われます。
この条件で結晶となった物質がダイヤモンドであり、電気を通さない絶縁物となります。
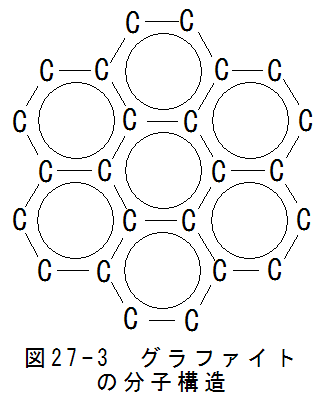 図27-3にグラファイトの分子構造を示します。グラファイトは図27-3に示すように炭素が平面的に6角形に配列
された分子構造を持ちます。
図27-3にグラファイトの分子構造を示します。グラファイトは図27-3に示すように炭素が平面的に6角形に配列
された分子構造を持ちます。
炭素同士は3個の共有結合で結ばれています。安定状態となるためには、もう1個の共有結合が必要なのですが、4個 めの共有結合は存在しません。
かわりに各炭素原子1個あたりに1個の自由電子を発生します。自由電子は炭素原子全体で共有され金属結合の状態 となります。自由電子は炭素構造体中を自由に移動できるため、導電体となります。
図27-2に示す炭素の電子配置からこのような状態となることを予測するのは難しいのですが、3個の共有結合による6角 形の構造体は極度に有効原子半径を小さくし、2pにある電子がはじき出されることを意味します。これは、2pの電子 軌道2個が消滅することを意味しています。
簡潔に表現するとグラファイトは金属と同じ特性を持つというこになります。従って、標準電極電位が存在するはずです。
マンガン乾電池の電圧は1.5Vであり、亜鉛の標準電極電位は-0.76Vですから
グラファイト標準電極電位=1.5-0.76=0.74V
となります。この値は銅の0.34Vよりも大きく、グラファイト電極は銅電極と比較して高い電圧が得られます。
- 2酸化マンガンの物性
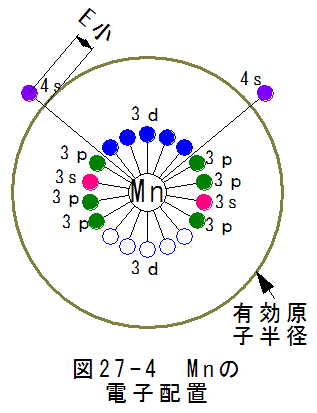
図27-4にマンガンの電子配置を示します。
図27-4から
(a)4sにある2個を自由電子として放出する。
(b)3dにある5個の空席を埋めようとする作用が働く。
以上の条件を満足するマンガンの化合物の分子構造を考えた場合、特定の分子式(成分比)を満足する分子構造が無限に 存在し、分子構造が特定できないという問題が生じます。
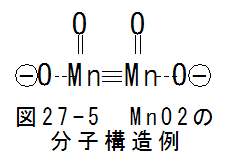 図27-5に2酸化マンガンの分子構造例を示します。3結合は不安定で通常は1重結合となります。図27-5は説明上の
仮想構造です。実際には3個の1重結合となるはずです。3個の共有結合は、面構造を形成します。
図27-5に2酸化マンガンの分子構造例を示します。3結合は不安定で通常は1重結合となります。図27-5は説明上の
仮想構造です。実際には3個の1重結合となるはずです。3個の共有結合は、面構造を形成します。
2酸化マンガンは水素と反応してMn(O)OHに変化します。 Mn(O)OHも分子構造を特定できません。
マンガンは反応の多様性があり分子構造を特定できないのですが、 2酸化マンガンは酸化剤として作用します。
- 塩化亜鉛の物性
塩化亜鉛は単純なイオン結合の物質で水に溶けるとマイナス塩素イオンとプラス亜鉛イオンとなります。
- 電解質中の亜鉛電極の反応
亜鉛電極はプラスに帯電するため、マイマスの塩素イオンが集まります。亜鉛はプラスに帯電し、塩素イオンからの引力が作用して
Zn → (+Zn) + 2e
の反応が発生します。
(+Zn)はプラス亜鉛イオンの意味であり、溶液中に溶解します。
2eは2個の電子の意味であり、導線を経由してグラファイト電極に流れます。
- 電解質中のグラファイト電極の反応
グラファイト電極はマイナスに帯電するため、プラスの亜鉛イオンが集まります。銅には余剰の電子があり、余剰電子が反応して
(+Zn) + e → Zn
の反応が起こるはずです。
しかし、金属亜鉛は、ただちに以下の反応を起こします。
Zn + H2O → (+Zn) + (-OH) + H2/2
上記の反応式において、Naは金属ナトリウム、H2Oは水です。 (+Zn)はプラスナトリウムイオンであり、 (-OH)は水酸イオン、 H2/2は水素ガスの半分を意味します。
- 2酸化マンガンの作用
グラファイト電極には水素ガスが発生し、その絶縁性のため、反応の阻害が生じます。
2酸化マンガンは水素と反応し
MnO2 + H2/2 → Mn(O)OH
の反応が生じて、水素ガスを吸収します。
- トータルの変化としては
Zn + 2(H2O) + 2MnO2 → (+Zn) + 2e + 2 (-OH) + 2Mn(O)OH
の変化が起こることになります。
亜鉛と銅の電位差は約1.5ボルトであり、2個の電子は約3eVエネルギーを発生したことになります。
反応が進行することにより、 (+Zn)、 (-OH)、 2Mn(O)OHが増大することになります。
マンガン乾電池は手軽で安全性に優れた電池です。また、使用済電池の電解質はアルカリ性となりますので、液漏れには注 意が必要です。
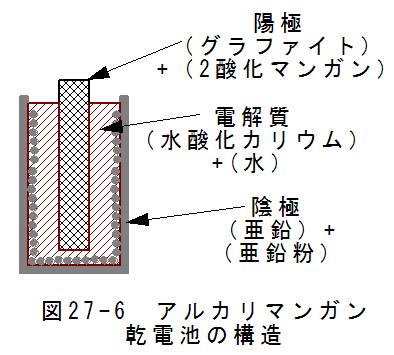
アルカリマンガン乾電池はマンガン乾電池の改良版でアルカリ電池と呼ばれています。
- アルカリマンガン乾電池の構造
図27-6にアルカリマンガン乾電池の基本構造を示します。円筒状の亜鉛容器が陰極となります。表面積を増やすため 亜鉛粉を用いています、中央に陽極があり、グラファイトと2酸化マンガンの混合物です。
陰極と陽極の間には水酸化カッリウムの水溶液が詰められています。
これで電池性能が向上するわけです。
- アルカリマンガン乾電池の陰極反応
亜鉛電極はプラスに帯電するため、マイマスの水酸イオンが集まります。亜鉛はプラスに帯電し、水酸イオンと反応して
Zn + 2(-OH) → ZnO + H2O + 2e
の反応が発生します。
(-OH)は水酸イオンの意味です。
2eは2個の電子の意味であり、導線を経由して陽極に流れます。
- アルカリマンガン乾電池の陽極反応
陽極はマイナスに帯電するため、プラスのカリウムイオンが集まります。陽極には余剰の電子があり、余剰電子が反応して
2(+K) + 2e → 2K
の反応が起こるはずです。
しかし、金属カリウムは、ただちに以下の反応を起こします。
2K + 2(H2O) → 2(+K) + 2(-OH) + H2
上記の反応式において、Kは金属カリウム、H2Oは水です。 (+K)はプラスカリウムイオンであり、 (-OH)は水酸イオン、 H2は水素ガスを意味します。
- 2酸化マンガンの作用
陽極電極には水素ガスが発生し、その絶縁性のため、反応の阻害が生じます。
2酸化マンガンは水素と反応し
2MnO2 + H2 → Mn2O3 + H2O
の反応が生じて、水素ガスを水にします。
- トータル陽極反応
2MnO2 + H2O + 2e→Mn2O3 + 2(-OH)
となります。
- アルカリマンガン乾電池トータル反応
アルカリマンガン乾電池トータル反応の変化としては
Zn + 2MnO2 → ZnO +Mn2O3
となります。
亜鉛と銅の電位差は約1.5ボルトであり、2個の電子は約3eVエネルギーを発生したことになります。
反応が進行することにより、Zn→ZnO、 2MnO2→ Mn2O3に変化することになります。
アルカリマンガン乾電池では、電解質が変化せず、陰極(Zn)が酸化され、陽極(2酸化マンガン)が還元されることになります。
ZnO膜が厚くなると抵抗が増大して、電流が減少することになります。
以上の反応は、可逆性ですので、原理的には充電が可能なはずですが、充電の副産物として、水素ガスと酸素ガスが発 生するため、破裂の可能性があります。また、表面積拡大のための亜鉛粉形状までは復元できず、特性劣化が生じると思われます。
それに、電解質は最初からアルカリ性ですので、液漏れには注意が必要です。
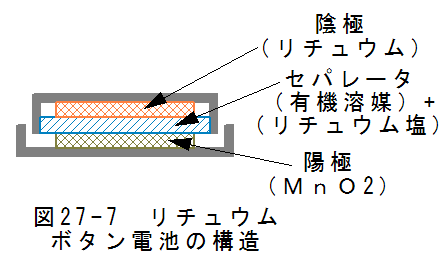
コイン形リチウム電池は、腕時計等小型の機器に良く使用されます。
普段手軽に使用していますが、その動作原理を理解しようとすると、難しいことに気づきます。ここでは、コイン形 リチウム電池の構造と動作原理について検討してみたいと思います。
- コイン形リチウム電池の構造
図27-7にコイン形リチウム電池の基本構造を示します。図27-7において、下側に2酸化マンガン(MnO2)がありこれ が陽極です。上側にリチウムがありこれが陰極です。間にセパレータがあり有機系の電解質に満たされています。
有機系の電解質は非プロトン系極性溶剤(プロピレンカーボネート等)に過塩素酸リチウム塩を溶かしたものです。(金属 リチウムは水と反応して水素を発生するため有機系を使用します。)
この構造で公称電圧3Vの電池となります。
- コイン形リチウム電池の陰極反応
リチウム電極はプラスに帯電するため、マイマスの塩素イオン等が集まります。リチウムはプラスに帯電し、塩素イオンか らの引力が作用して
Li → (+Li) + e
の反応が発生します。
(+Li)はリチウムイオンの意味です。
2eは2個の電子の意味であり、導線を経由して陽極に流れます。
- コイン形リチウム電池の陽極反応
陽極はマイナスに帯電するため、プラスのリチウムイオンが集まります。陽極には余剰の電子があり、余剰電子が反応して
MnO2 + (+Li) + e → MnO2Li
の反応が起こります。
- コイン形リチウム電池トータル反応
コイン形リチウム電池トータル反応の変化としては
Li + MnO2 → MnO2Li
となります。
リチウムの標準電極電位は-3.045Vであり、トータルの電圧が3VですのでMnO2電極の標準電極電位は0Vということになります。
しかし、MnO2は金属酸化物であり、固体では絶縁体のはずです。しかし、 MnO2は溶液中で(+Mn)イオンと(-O)イオンに分離し 導電性を示すと考えられます。
また、マンガン化合物は分子式としては表現できるのですが、多数の共有結合が生じるため分子構造の特定が困難な物 質です。分子構造としては多様な構造をとる可能性があります。
コイン形リチウム電池の構造はシンプルですが、優れた特性を持つ電池です。