二次電池とは、充電式電池のことです。二次電池はデジカメ、携帯、自動車等身近に使用されています。そして、今後 の電気エネルギー安定化には不可欠であり、ますます重要度が増してくると思います。
二次電池には、鉛蓄電池、ニッケル・カドミウム蓄電池、ニッケル・水素蓄電池、リチウムイオン二次電池等があります。
表28-1 二次電池の比較
| 種類 | 電圧 | エネルギー密度 | 効率 | コスト | サイクル |
| 単位 | (V) | (Wh/kg) | (%) | ¥/KWh | (回) |
| 鉛蓄電池 | 2.1 | 35 | 81 | 12,769 | 650 |
| ニッケル・カドミウム蓄電池 | 1.2 | 50 | 80 | − | 1500 |
| ニッケル・水素蓄電池 | 1.2 | 55 | 66 | 60,584 | 1000 |
| リチウムイオン二次電池 | 3.6 | 160 | 99.9 | 21,282 | 1200 |
・ 鉛蓄電池は古くからの二次電池で自動車に多く用いられてきました。エネルギー密度は35W/kgと小さいのですが、 コストは¥12,769/kWhと小さいのが特徴です。
・ニッケル・カドミウム蓄電池は、充電式の乾電池代用として古くから使用されてきました。公害の問題から、ニッ ケル・水素蓄電池変わってきています。
・ニッケル・水素蓄電池は充電式の乾電池代用が可能ですがコストが欠点です。
・リチウムイオン二次電池はエネルギー密度が160Wh/kgと高く、コストも¥21,282/kWまで下がってきています。
一般家庭でどのくらいの電力を消費しているかは、かなりばらつきがあります。電気代は¥21/KWhということですの で、10kWh/日消費する家庭で月当たりの電気代は21×10×30=¥6300/月ということになります。
エアコン等使用の多い家庭では、 30kWh/日程度になりそうです。
1日分の電気を蓄電する場合、鉛蓄電池で¥383,000、リチウムイオン二次電池で¥638,000の費用が発生することにな ります。実際に使用する場合は、過度な放電や充電は電池をいためますので、蓄電容量には余裕が必要です。蓄 電容量の余裕まで考慮するならば、コスト低減が課題といえます。
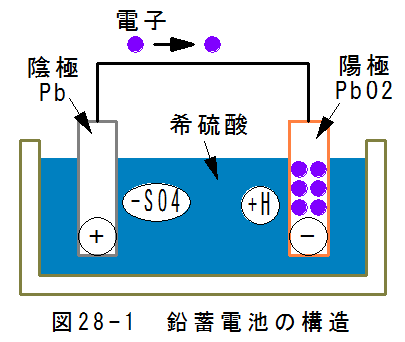
- 鉛蓄電池の構造
図28-1に鉛蓄電池の構造を示します。鉛蓄電池は、正極(陽極板)に二酸化鉛、負極(陰極板)には海綿状の鉛、電解 液として希硫酸を用いた二次電池です。
これで、蓄電池として機能するわけですが、反応の詳細を理解するのは、鉛の物性を理解する必要があります。
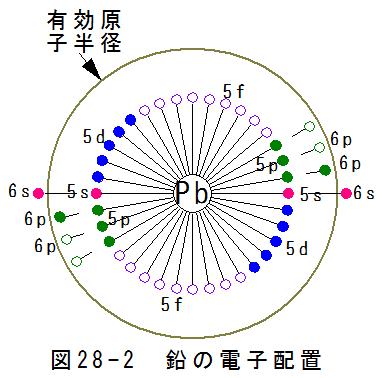
- 鉛の電子配置
図28-2に鉛の電子配置を示します。図28-2において、軌道5dまでは満席となっています。5fは全て空席、6sは満席 、6pは6個中2個の電子が埋まっています。
鉛の電子配置に関して、新たな仮説が必要となります。軌道6sと6pのポテンシャルは同じですが、6pはスピンを持 つため磁気引力が発生し、ポテンシャルに歪みが発生します。このため、軌道6sは有効原子半径の外側、軌道6pは内側に 配置されると仮定します。
この電子配置において、鉛は以下の2つの条件で反応すると予測されます。
第1条件
・軌道6sの2個の電子を自由電子として放出する。
・軌道6pの4個の空席を埋めようとする作用が働く。
・軌道6pで共有結合可能な個数は2個である。
第2条件
・軌道6sの電子2個と軌道6pの電子2個を自由電子として放出する。
第1条件と第2条件のエネルギー差は僅かでどちらかの条件となりますが、第1条件がより安定な条件と思われます。
- 硫酸の物性
硫酸(H2SO4)は水に溶けるとマイナス硫酸イオン(-SO4)とプラス水素イオン(+H)となります。
- 電解質中のPb電極(陰極)の反応
鉛電極はプラスに帯電するため、マイナス硫酸イオン(-SO4)が集まります。鉛はプラスに帯電し、マイナス硫酸イオン(-SO4) と反応して
Pb + (-SO4) → PbSO4 + 2e
の反応が発生します。
2eは2個の電子の意味であり、導線を経由してグラファイト電極に流れます。
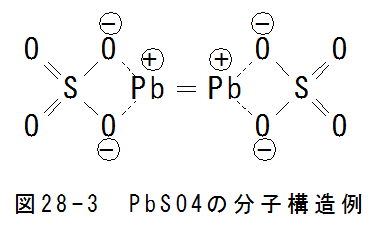
図28-3にPbSO4の分子構造例を示します。Pb間の2重結合は不安定であり、実際は繊維状の構造体になると思われます。
金属Pbは鉛の第2条件の状態であり、 PbSO4はより安定な第1条件の状態です。この差がエネルギーを生み出すと考えられます。
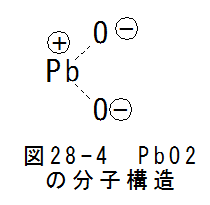
- 電解質中のPbO2(陽極)電極の反応
図28-4にPbO2の分子構造を示します。 PbO2は単純イオン結合であり、マイナス酸素イオンとプラス鉛イオンに分離します。
PbO2(陽極)電極はマイナスに帯電するため、プラスの水素イオン(+H)が集まります。 PbO2(陽極)電極には余剰の電子 があり、余剰電子が反応して
PbO2 + 4(+H) + 2e → (+ Pb) + 2(H2O)
次に
(+ Pb) + (-SO4) → PbSO4
PbO2(陽極)電極トータルでは
PbO2 + 4(+H) + (-SO4) + 2e → PbSO4 + 2(H2O)
の反応が起こります。
- 鉛蓄電池トータル反応
Pb+PbO2+2(H2SO4) → 2(PbSO4)+2(H2O)
となります。
Pb+PbO2は第2条件の状態であり、 PbSO4は第1条件の状態です。この変化の起電力は約2Vです。
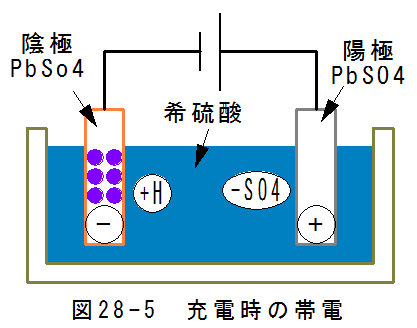
- 充電時の陰極反応
図28-5に充電時の帯電を示します。
陰極はマイナスに帯電するため、プラス水素イオン(+H)が集まります。 プラス水素イオン(+H)は電子を 得て、水素ラジカルに変化します。
(+H) + e → H
水素ラジカルはPbSO4を還元します。
PbSO4 + 2H → Pb + H2SO4
の反応が発生します。
陰極トータル反応は
PbSO4 + 2(+H) + 2e → Pb + H2SO4
- 充電時の陽極反応
陽極はプラスに帯電するため、 (-SO4) イオンが集まります。
電子が奪われるの作用により
(-SO4) - 2e → SO4
SO4は水と反応し
SO4 + H2O → O + H2SO4
酸素ラジカルはPbSO4を酸化します。
PbSO4 + O + H2O → PbO2 + H2SO4
の反応が発生します。
陽極トータル反応は
PbSO4 + (-SO4) + 2(H2O) - 2e → PbO2 + 2(H2SO4)
- 充電時のトータル反応
2(PbSO4)+2(H2O) → Pb+PbO2+2(H2SO4)
となります。
- 充電時の注意事項
充電時、陽極には酸素ラジカルが発生し、 PbSO4を酸化して PbO2に変化させますが、一部が酸素ラジカル同士の反応が起こ り酸素ガスが発生します。 PbSO4がなくなると全てが酸素ガスとなります。
陰極では、水素ラジカルが発生し、 PbSO4をPbに還元しますが一部は水素ラジカル同士が反応して水素ガスとな ります。 PbSO4がなくなると全て水素ガスとなります。
過充電を行いますと多量の酸素ガスと水素ガスが発生しますので、内圧が上がり危険な状態となります。
過充電前に充電を自動停止する必要があります。また、発生した酸素ガスと水素ガスを水に戻す仕掛けが必要です。
- 過放電の注意事項
完全に放電すると負極(陰極板)の海綿状の鉛の形状が劣化して、蓄電特性が悪化します。
過放電時は放電を自動停止する仕掛けが必要です。
- エネルギー損失
発生した水素ガスと酸素ガスを単純に反応させて水に戻した場合は、熱となるためエネルギー損失となります。
発生した水素ガスと酸素ガスを電気に戻す仕掛けを用いると効率は向上しますが、コストの問題があり今後の課題でしょう。
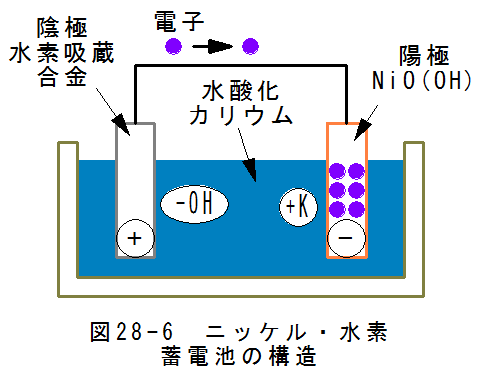
- ニッケル・水素蓄電池の構造
図28-6にニッケル・水素蓄電池の構造を示します。ニッケル・水素蓄電池は、正極(陽極板)にオキシ水酸化ニッケル 、負極 (陰極板)には水素吸蔵合金、電解液として水酸化カリウムを用いた二次電池です。
これで、蓄電池として機能するわけです。
- 電解質中の水素吸蔵合金(陰極)の反応
陰極はプラスに帯電するため、水酸イオン(-OH)が集まります。水素吸蔵合金(陰極)はプラスに帯電し、水酸イオン( -OH)と反応して
H + (-OH) → H2O + e
の反応が発生します。
eは1個の電子の意味であり、導線を経由して陽極に流れます。
- 電解質中のオキシ水酸化ニッケル (陽極)電極の反応
オキシ水酸化ニッケル (陽極)電極はマイナスに帯電するため、プラスのカリウムイオン(+K)が集まります。オキシ水酸 化ニッケル (陽極)電極には余剰の電子があり、余剰電子が反応して
(+K) + e → K
の反応が起こるはずです。
しかし、金属カリウムは、ただちに以下の反応を起こします。
K + H2O → (+K) + (-OH) + H
次に
NiOOH + H → Ni(OH)2
の反応が起こります。
オキシ水酸化ニッケル (陽極)電極トータルでは
NiO(OH) + H2O + e → Ni(OH)2 + (-OH)
の反応が起こります。
- ニッケル・水素蓄電池トータル反応
NiO(OH) + H → Ni(OH)2
となります。
この変化の起電力は約1.2Vです。
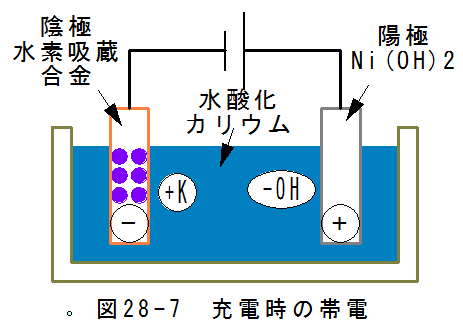
- 充電時の陰極反応
図28-7に充電時の帯電を示します。
陰極はマイナスに帯電するため、カリウムイオン(+K)が集まります。
陰極には余剰の電子があり、余剰電子が反応して
(+K) + e → K
の反応が起こるはずです。
しかし、金属カリウムは、ただちに以下の反応を起こします。
K + H2O → (+K) + (-OH) + H
水素ラジカル同士は反応して水素ガスとなり、水素吸蔵合金に吸収されます。
陰極トータルの反応は
H2O + e → (-OH) + H
となります。
- 充電時の陽極反応
陽極はプラスに帯電するため、 (-OH) イオンが集まります。
また、電子が奪われるため下記の反応が起こります。
Ni(OH)2 + (-OH) - e → NiO(OH) + H2O
- 充電時のトータル反応
Ni(OH)2 →NiO(OH) + H
となります。
- 充電時の注意事項
充電時、陽極には酸素ラジカルが発生し、 Ni(OH)2を酸化して NiO(OH)に変化させますが、一部が酸素ラジカル同士 の反応が起こり酸素ガスが発生します。 Ni(OH)2がなくなると全てが酸素ガスとなります。
陰極では、水素ガスが発生し、水素吸蔵合金に吸収されます。 過充電を行いますと多量の酸素ガスと水素ガスが発生します ので、内圧が上がり危険な状態となります。
過充電前に充電を自動停止する必要があります。
- ニッケル・水素蓄電池の課題
水素吸蔵合金は希土類元素(レア・アース)を用いたものが多く、コスト低減が難しい問題があります。
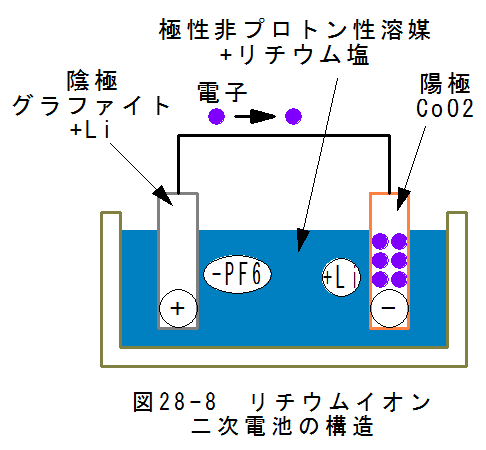
- リチウムイオン二次電池の構造
図28-8にリチウムイオン二次電池の構造を示します。リチウムイオン二次電池は、正極(陽極板)にコバルト酸リチウム( LiCoO2)、負極(陰極板)にはグラファイト、電解液として極性非プロトン性溶媒+リチウム塩を用いた二次電池です。
極性非プロトン性溶媒としては、炭酸エチレンや炭酸ジエチルなどが使用されます。
リチウム塩としては、LiPF6 の他、LiBF4 、LiN(SO2R)2、LiC(SO2R)3 (ただしR= CF3、C2F5)などが使用されます。
図28-8は充電済、放電中の状態図で、陽極はCoO2、陰極はグラファイト+Liとなっています。これで、蓄電池として機能し ます。リチウムイオン二次電池の陽極材料と陰極材料は、完全放電後の状態での材料です。(ちょっとまぎわらしいのですが)
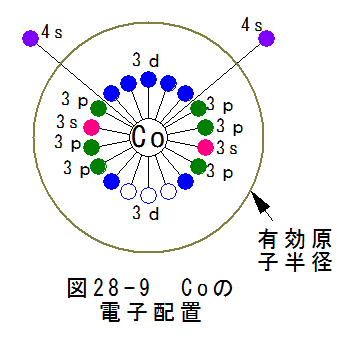
- コバルトの電子配置
図28-9にコバルトの電子配置を示します。
図28-9から
(a)4sにある2個を自由電子として放出する。
(b)3dにある3個の空席を埋めようとする作用が働く。
以上の条件を満足する鉄の化合物の分子構造を考えた場合、特定の分子式(成分比)を満足する分子構造が無限に存在し 、分子構造が特定できないという問題が生じます。
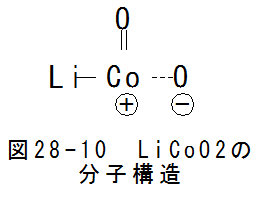
- コバルト酸リチウム(LiCoO2)の分子構造
図28-10にコバルト酸リチウム(LiCoO2)の分子構造を示します。
図28-10の構造から、コバルト酸リチウムは容易に酸化コバルトとリチウムに分離することが予測されます。
- 電解質中のLiCoO2(陰極)の反応
グラファイト+Li(陰極)はプラスに帯電し、 (-PF6)イオンからの引力が作用して
Li → (+Li) + e
の反応が起こります。
eは1個の電子の意味であり、導線を経由して陽極に流れます。
- 電解質中の酸化コバルト(CoO2) (陽極)電極の反応
グラファイト(陽極)電極はマイナスに帯電するため、プラスのリチウムイオン(+Li)が集まります。グラファイ ト(陽極)電極には余剰の電子があり、余剰電子が反応して
CoO2 + (+Li) + e → LiCoO2
の反応が発生します。
リチウムイオン二次電池トータル反応
CoO2 + Li → LiCoO2
となります。
この変化の起電力は約3.7Vです。
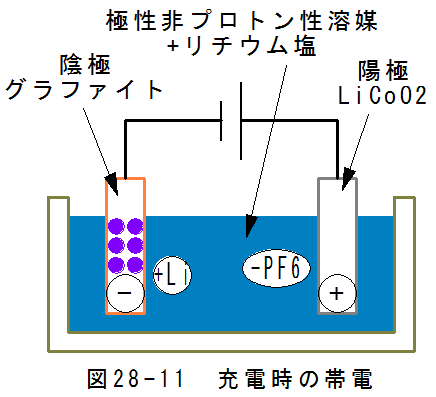
- 充電時の陰極反応
図28-11に充電時の帯電を示します。
陰極はマイナスに帯電するため、リチウムイオン(+Li)が集まります。
陰極には余剰の電子があり、余剰電子が反応して
(+Li) + e → Li
の反応が起こります。
金属リチウムはグラファイトに固着します。
- 充電時の陽極反応
陽極はプラスに帯電するため、 (-PF6) イオンが集まります。
また、 (-PF6) イオンの引力により下記の反応が起こります。
LiCoO2 - e → (+Li) + CoO2
- 充電時のトータル反応
LiCoO2 → Li + CoO2
となります。
- オーバー充電時の反応
充電完了後の陽極はLiCoO2が無くなり、 CoO2となります。さらにオーバー充電を行うと陽極では、以下の反応が生じると考えられます。
CoO2 - e → (+CoO) + O (+CoO)はプラスイオンであり、陰極に引かれCoOに変化、Oは酸素ラジカルであり、陰極のLiと反応してLi2Oに変化またはO2ガスに変化 すると思われます。
従って、オーバー充電を行うと陽極が溶け出し破壊される可能性が考えられます。
- リチウムイオン二次電池の課題
コバルトは希少金属であり、コスト低減が難しい問題があります。
コバルトは希少金属であり、コバルトを使用しないリチウムイオン二次電池の研究開発が盛んです。
コバルトを使用しないリチウムイオン二次電池の陽極材料としては、LiMn2O4、LiNiO2、LiFePO4等があります。
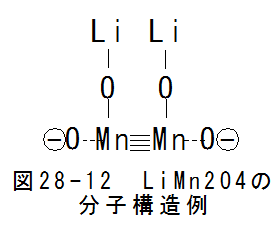
- LiMn2O4
2酸化マンガンとリチウムの化合物で分子構造を特定できないのですが、図28-12にLiMn2O4の分子構造例を示します。
図28-12において、LiMnO2となっています。 LiMn2O4の条件でうまく結合条件があてはまりせんでした。 LiMn2O4はMnO2 とLiMnO2の混合物と考えることができます。マンガンは多様な結合をし、分子構造が特定できません。理解の難しい材料です。
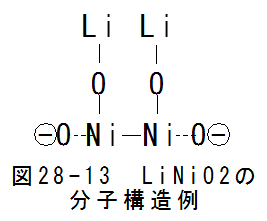
- LiNiO2
2酸化ニッケルとリチウムの化合物ですが、図28-13にLiNiO2の分子構造例を示します。 LiNiO2は比較的単純な分子構造となり ます。しかし、ニッケルは比較的高価な材料ですので、大量に消費する場合は、コスト上のネックとなりそうです。
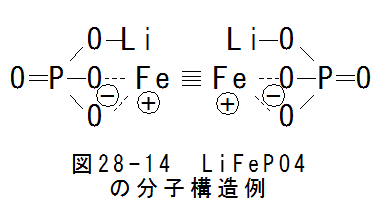
- LiFePO4
燐酸鉄とリチウムの化合物ですが、図28-14にLiFePO4の分子構造例を示します。
図28-14 において、4重結合がありますが、4重結合は不安定で4個の共有結合となります。4個の共有結合は立体構造となりま すが、厳密には分子構造を特定できません。 しかし、燐酸鉄は安価な材料ですので、コストダウンが可能な材料です。
リチウムイオン二次電池は優れた特性を持つ電池です。しかも、陽極材料を変更すれば、大幅なコストダウンも可能なはずで す。将来の電力供給において、リチウムイオン二次電池はますます重要になると思われます。