燃焼によるエネルギーは太古の昔から利用されてきました。ここでは、燃焼によるエネルギーについて検討してみたいと思います。
原子が結合するとエネルギーを放出します。逆に結合を切るにはエネルギーを必要とします。このエネルギー量は原子同士の組み合わせによって変化します。
結合を切るエネルギーより結合するエネルギーが大きくなる化学反応において、結果的にエネルギーが放出されます。この化学反応を燃焼といいます。
さて、原子結合のエネルギーは原子の組合せに依存する訳ですが、主な組合せの原子結合エネルギーを表30-1に示します。
表30-1 主な組合せの原子結合エネルギー
| 原子間の結合 | Kcal/mol | kJ/mol | J/個 | eV/個 | 光子波長(nm) |
| H-H (H2) | 103 | 431 | 7.16E-19 | 4.48 | 277 |
| O-O (O2) | 118 | 494 | 8.21E-19 | 5.13 | 242 |
| O - O | 35 | 147 | 2.44E-19 | 1.53 | 812 |
| H-O (H-OH) | 110 | 459 | 7.62E-19 | 4.77 | 260 |
| C - C | 88 | 368 | 6.11E-19 | 3.82 | 325 |
| C = C | 141 | 590 | 9.80E-19 | 6.13 | 202 |
| C-O (OC=O) | 191 | 799 | 1.33E-18 | 8.30 | 149 |
| C-O (C≡O) | 255 | 1068 | 1.77E-18 | 11.08 | 112 |
| C-O (CH3-OH) | 85 | 356 | 5.91E-19 | 3.69 | 336 |
| C-H (CH3O-H) | 98 | 411 | 6.83E-19 | 4.27 | 291 |
| Si-H (SiH4) | 76 | 318 | 5.29E-19 | 3.30 | 375 |
| Si-O (SiO2) | 150 | 628 | 1.04E-18 | 6.52 | 190 |
| 〃 (SiO) | 105 | 440 | 7.30E-19 | 4.56 | 272 |
| N - H | 92 | 386 | 6.41E-19 | 4.01 | 309 |
| C-Cl (CH3Cl) | 80 | 335 | 5.56E-19 | 3.48 | 357 |
| H-F (HF) | 135 | 565 | 9.39E-19 | 5.87 | 211 |
| Cl-Cl(Cl2) | 57 | 239 | 3.96E-19 | 2.48 | 500 |
| H-Cl (HCl) | 102 | 427 | 7.09E-19 | 4.43 | 280 |
| Br-Br(Br2) | 45 | 188 | 3.13E-19 | 1.96 | 634 |
| H-I (HI) | 70 | 293 | 4.87E-19 | 3.04 | 407 |
| H-Br (HBr) | 87 | 364 | 6.05E-19 | 3.78 | 328 |
| B-Cl (BCl3) | 106 | 444 | 7.37E-19 | 4.61 | 269 |
| Fe-Cl(FeCl3) | 82 | 343 | 5.70E-19 | 3.56 | 348 |
| Cu-Cl(Cu-Cl) | 89 | 373 | 6.19E-19 | 3.87 | 320 |
| Si-Cl(SiCl4) | 95 | 398 | 6.61E-19 | 4.13 | 300 |
| Na-Br(NaBr) | 84 | 352 | 5.84E-19 | 3.65 | 340 |
| K-Br (KBr) | 91 | 381 | 6.33E-19 | 3.96 | 313 |
| Ca-Br(CaBr2) | 92 | 385 | 6.40E-19 | 4.00 | 310 |
| Mg-Cl(MgCl2) | 93 | 389 | 6.47E-19 | 4.04 | 307 |
| Al-Cl(AlCl3) | 101 | 423 | 7.02E-19 | 4.39 | 282 |
| Ca-Cl(CaCl2) | 109 | 456 | 7.58E-19 | 4.74 | 262 |
| Cu-O (CuO) | 81 | 339 | 5.63E-19 | 3.52 | 352 |
| Al-O (Al-O) | 115 | 481 | 8.00E-19 | 5.00 | 248 |
| Ba-O(BaO) | 132 | 553 | 9.18E-19 | 5.74 | 216 |
| Ti-O (TiO2) | 145 | 607 | 1.01E-18 | 6.30 | 197 |
| B-O (B-O) | 190 | 795 | 1.32E-18 | 8.26 | 150 |
| Na-O (NaOH) | 86 | 360 | 5.98E-19 | 3.74 | 332 |
| K-O (KOH) | 90 | 377 | 6.26E-19 | 3.91 | 317 |
| Li-O (LiOH) | 105 | 440 | 7.30E-19 | 4.56 | 272 |
| Mg-O (MgO) | 88 | 368 | 6.12E-19 | 3.83 | 324 |
| Ca-O (CaO) | 91 | 381 | 6.33E-19 | 3.96 | 313 |
| Na-Cl(NaCl) | 97 | 406 | 6.75E-19 | 4.22 | 294 |
| K-Cl (KCl) | 101 | 423 | 7.02E-19 | 4.39 | 282 |
| Li-Cl(LiCl) | 112 | 469 | 7.79E-19 | 4.87 | 255 |
| Na-F (NaF) | 113 | 473 | 7.86E-19 | 4.91 | 252 |
| K-F (KF) | 117 | 490 | 8.14E-19 | 5.09 | 244 |
| Cu-F (CuF2) | 94 | 394 | 6.54E-19 | 4.09 | 303 |
| Fe-F (FeF2) | 114 | 477 | 7.93E-19 | 4.96 | 250 |
| Mg-F (MgF2) | 122 | 511 | 8.48E-19 | 5.30 | 234 |
| Ca-F (CaF2) | 133 | 557 | 9.25E-19 | 5.78 | 214 |
| Al-F (AlF3) | 140 | 586 | 9.74E-19 | 6.09 | 204 |
| Si-F (SiF4) | 142 | 595 | 9.88E-19 | 6.17 | 201 |
| Ⅰ -Ⅰ | 36 | 149 | 2.48E-19 | 1.55 | 801 |
表30-1の値は目安であり厳密な値ではありません。エネルギーの単位としてはKcal/mol、kJ/mol、J/個、eV/個、光子波長(nm)で併記しました。
Kcal/molは温度上昇を検討するのに便利な単位です。 、kJ/molは標準エネルギー単位です。 eV/個が電位を検討するのに便利です。光子波長(nm)はeVに対応する波長です。
まずは、水素ガスと酸素ガスの反応について検討してみたいと思います。
- 水素ガスの電子配置
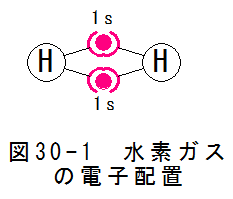
図30-1に水素ガスの電子配置を示します。
水素原子は軌道1sに1個の電子と1個の空席を持ちます。空席を埋める作用が働き、1組の共有結合が生じます。
この共有結合のエネルギーが103kcal/mol(4.48eV)です。この結合エネルギーは軌道1sのポテンシャルエネルギーとは一致しなくなると考えられます。
なぜならば、2個の電子が2個の水素原子核にはさまれた状態となり、電子同士の反発力が働くと考えられます。 すなわち、結合エネルギーは軌道のポテンシャルエネルギーと一致しないで、元素同士の結合状態に依存すると考えられます。
- 酸素ガスの電子配置
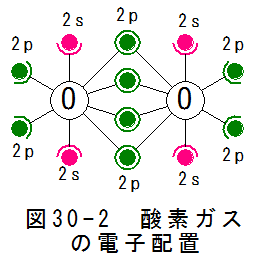
図30-2に酸素ガスの電子配置を示します。
酸素原子は軌道2sに2個の電子、軌道2pに2個電子と2個の空席を持ちます。空席を埋める作用が働き、2組の共有結合が生じます。
この共有結合のエネルギーが118kcal/mol(5.13eV)です。 2組の共有結合で118kcal/mol(5.13eV)ですので、1組あたりはこの半分となります。 1組あたり 結合エネルギーは59kcal/mol(2.56eV)と小さめです。
結合エネルギーが小さくなる理由としては、2重の共有結合により、電子がより多く集中して、電子同士の反発力が大きくなるためと思われます。
すわわち、酸素ガスは2重の共有結合により、1組あたりの結合エネルギーが小さくなります。
- H2Oの電子配置
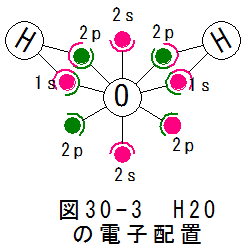
図30-3にH2Oの電子配置を示します。
酸素と水素間で1組の供給結合は生じます。水素は2個ですので2組の共有結合があります。
1組あたりの結合エネルギーは110kcal/mol(4.77eV)です。 2組の結合エネルギーは220kcal/mol(9.53eV)です。
- 水素と酸素の反応エネルギー
水素ガス2個と酸素ガス1個は反応すると2個のH2Oができます。
水素ガス2個と酸素ガス1個の結合エネルギー
=2× 103kcal/mol(4.48eV)+ 118kcal/mol(5.13eV)=324 kcal/mol(14.08eV)
H2Oが2個の結合エネルギー
=2× 220kcal/mol(9.53eV) =440 kcal/mol(19.06eV)
したがって、反応で発生するエネルギー
= 440 kcal/mol(19.06eV)- 324 kcal/mol(14.08eV)=116 kcal/mol(4.98eV)
となります。
私達がよく使用する燃料は、都市ガス、プロパンガス、灯油、ガソリン等ですが、これらは太古の昔の植物が変質したもので、炭素と水素の化合物です。
これらの燃料は資源に限りがあるのと、二酸化炭素放出による地球温暖化の問題が生じていますが、大変便利な燃料です。
炭素と水素の化合物の種類はさまざまですが、ここでは一番簡単な分子構造のメタンと酸素の燃焼について検討します。
- メタンガスの電子配置
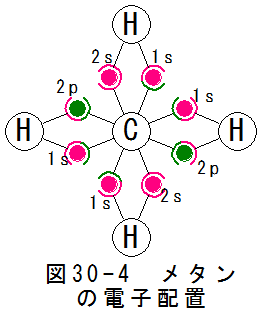
図30-4にメタンガスの電子配置を示します。
メタンガスは1個の炭素に4個の水素が共有結合した分子構造をしています。
この共有結合のエネルギーは1組あたり、98kcal/mol(4.27eV)です。
共有結合が4組あるため、メタンガスの結合エネルギー
= 98kcal/mol(4.27eV)×4= 393kcal/mol(17.07eV)
となります。
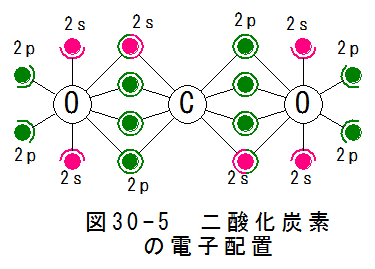
- 二酸化炭素の電子配置
図30-5に二酸化炭素の電子配置を示します。
二酸化炭素は1個の炭素に2個の酸素が共有結合した分子構造をしています。
この共有結合のエネルギーは1組あたり、191kcal/mol(8.30eV)です。
共有結合が2組あるため、メタンガスの結合エネルギー
= 191kcal/mol(8.30eV) ×2= 382kcal/mol(16.59eV)
となります。
- メタンガスと酸素の反応エネルギー
メタンガス1個と酸素ガス2個が反応すると2個のH2Oと1個のCO2ができます。
メタンガス1個と酸素ガス4個の結合エネルギー
= 393kcal/mol(17.07eV) + 2×118kcal/mol(5.13eV)=629 kcal/mol(27.33eV)
2個のH2Oと1個のCO2の結合エネルギー
=2× 220kcal/mol(9.53eV)+ 382kcal/mol(16.59eV) =822 kcal/mol(35.65eV)
したがって、反応で発生するエネルギー
=822 kcal/mol(35.65eV)- 629 kcal/mol(27.33eV)=193 kcal/mol(8.32eV)
となります。
- 反応エネルギーの比較
水素ガス2個と酸素ガス1個の反応ネルギーが116 kcal/mol(4.98eV)
メタンガス1個と酸素ガス2個の193 kcal/mol(8.32eV)
という結果になりましたが、ちょっとメタンガスの反応エネルギーが小さいようです。
表30-1の原子結合エネルギーの値は参考値であり正確ではないためと思われます。大まかな目安であり、厳密には反応エネルギーの精密測定が必要と思われます。