触媒とは、特定の化学反応の反応速度を速める物質で、自身は反応の前後で変化しないものをいう。また、反応によって消費されても、反応の完了と同時に再生し、変化していない ように見えるものも触媒とされる。
触媒は化学反応においてなくてはならない物質です。しかし、どのような原理で反応速度を速めるのか?ここでは、触媒がどのような原理で作用するのかを検討してみたいと思います。
- 木材の燃焼灰
乾燥した木材を燃焼させると、最初は水素を多く含みガス化しやすい成分が燃焼し炎がでます。次に炭の成分が燃焼し、最後に灰が残ります。
灰には炭酸カリウムが多く含まれています。炭酸カリウムは燃焼の触媒作用があり、灰に包まれた炭は穏やかに長時間燃焼します。一度燃焼した木 材の残り火が長時間くすぶり続けるのはよく経験しますが、これは、灰に含まれる炭酸カリウムの触媒作用によるものです。
また、木材の燃焼灰を水に溶かすと炭酸カリウムの水溶液となりアルカリ性となります。炭酸カリウムの水溶液を「かんすい」ともいいます。
小麦粉を少量の「かんすい」を含む水をまぜ練り上げて麺にすると「ラーメン」ができます。
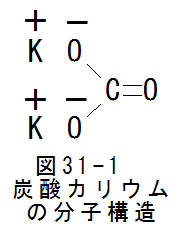
- 炭酸カリウムの分子構造
図31-1に炭酸カリウムの分子構造を示します。図31-1の分子構造から、炭酸カリウムは水に良く溶けてイオン化することがわかります。水溶液がアルカリ性となる のは、炭酸イオンが分解して水酸イオン(-OH)と炭酸ガス(CO2)に変化するためと思われます。
しかし、図31-1の分子構造から触媒作用の原理を説明するのは困難です。
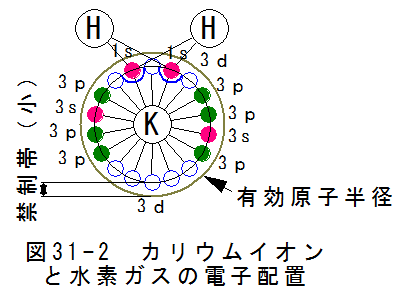
- カリウムイオンの触媒作用と電子配置
図31-2にカリウムイオンと水素ガスの電子配置を示します。
カリウムは最外周の軌道4sに1個の電子をもちますが、4sの電子は炭酸イオンに吸い取られ、全体としてはプラスに帯電します。
カリウムイオンは有効原子半径のすぐ下に軌道3dが10個あり全て空席になっています。軌道3dと有効原子半径との間が禁制帯ですが、禁制帯が小さいとき、 水素ガスで共有結合されている2個の電子は、カリウムイオンの軌道3dに捕捉されます。
水素ガスもカリウムイオンも絶対零度以外では熱運動をしています。20℃の常温での絶対温度は293°Kとなり、激しく熱運動をしています。
水素ガスで共有結合している電子がカリウムイオンの軌道3dに捕捉された場合、質量の大きい熱運動が共有結合している電子に加わることになります。
このため、比較的低温で水素ガスで共有結合が破壊されます。共有結合が破壊された水素ガスは反応性の高い水素ラジカルに変化します。
同様な原理で酸素ガスの共有結合も低温で破壊され、反応性の高い酸素ラジカルに変化します。
水素ラジカルと酸素ラジカルはただちに反応しH2Oに変化します。この時結合エネルギーにひってきするエネルギーを放出します。
触媒は共有結合の電子を狙い撃ちするハンマーのような作用をもちます。このハンマー効果は、ハンマーの速度(温度に相当)と質量(原子量)が大きいほど破壊効果が高いことになります。
- 触媒に適した元素の予測
非常に強い触媒効果を持つ元素としては白金(Pt)が知られています。白金に水素ガスを吹き付けると常温で発火します。また、白金触媒の応用例としては、白金カイロがあり ます。白金カイロは、燃料のベンジンを直接燃やすのではなく、気化したベンジンが白金の触媒作用で徐々に酸化発熱する仕組みになっています。また火口が単なる石綿やガ ラス繊維でなく、白金を加工した”白金発熱体”となっています。
白金が強い触媒効果を持つのは、良く知られています。なぜ白金が強い触媒作用をもつのでしょうか?
そもそも、触媒とは共有結合の電子を捕捉し、集中的に衝撃エネギーを与えるハンマーのような道具と考えるべきでしょう。
この条件として
(1)十分な質量を持つ。(ハンマーは重い方が強力となります。)
(2)共有結合の電子を捕捉しやすい。(有効原子半径内に電子軌道の空席があるのと空席と有効原子半径間のエネルギーギャップ(禁制帯)が小さい必要があります。)
残念ながら、各種元素の空席と有効原子半径間のエネルギーギャップ(禁制帯)は不明です。しかし、大まかな相関ですが、比重を原子量で割った値が大きいほど、エネルギー ギャップ(禁制帯)が小さくなる傾向があるはずです。
表31-1 に各種元素の原子量、比重、比重/原子量を示します。
表31-1 各種元素の原子量、比重、比重/原子量
元素記号 原子量 比重 比重/原子量 K 39 0.862 0.022102564 Ca 40 1.55 0.03875 Sc 45 2.985 0.066333333 Ti 48 4.506 0.093875 V 51 6 0.117647059 Cr 52 7.19 0.138269231 Mn 55 7.21 0.131090909 Fe 56 7.87 0.140535714 Co 59 8.9 0.150847458 Ni 59 8.91 0.151016949 Cu 64 8.94 0.1396875 Zn 65 7.14 0.109846154 Ga 70 5.91 0.084428571 Rb 85 1.53 0.018 Sr 88 2.64 0.03 Y 89 4.47 0.050224719 Zr 91 6.52 0.071648352 Nb 93 8.57 0.092150538 Mo 96 10.28 0.107083333 Tc 98 11 0.112244898 Ru 101 12.45 0.123267327 Rh 103 12.41 0.120485437 Pd 106 12.02 0.113396226 Ag 108 10.49 0.09712963 Cd 112 8.65 0.077232143 In 115 7.31 0.063565217 Sn 119 7.37 0.061932773 Cs 133 1.93 0.014511278 Ba 137 3.51 0.025620438 Hf 178 13.31 0.074775281 Ta 181 16.69 0.092209945 W 184 19.25 0.104619565 Re 186 21.02 0.113010753 Os 190 22.59 0.118894737 Ir 192 22.56 0.1175 Pt 195 21.45 0.11 Au 197 19.3 0.097969543 Hg 201 13.53 0.067313433 TI 204 11.85 0.058088235 Pb 207 11.34 0.054782609 Bi 209 9.78 0.046794258
図31-3に各種元素の「比重/原子量」の値の棒グラフを示します。
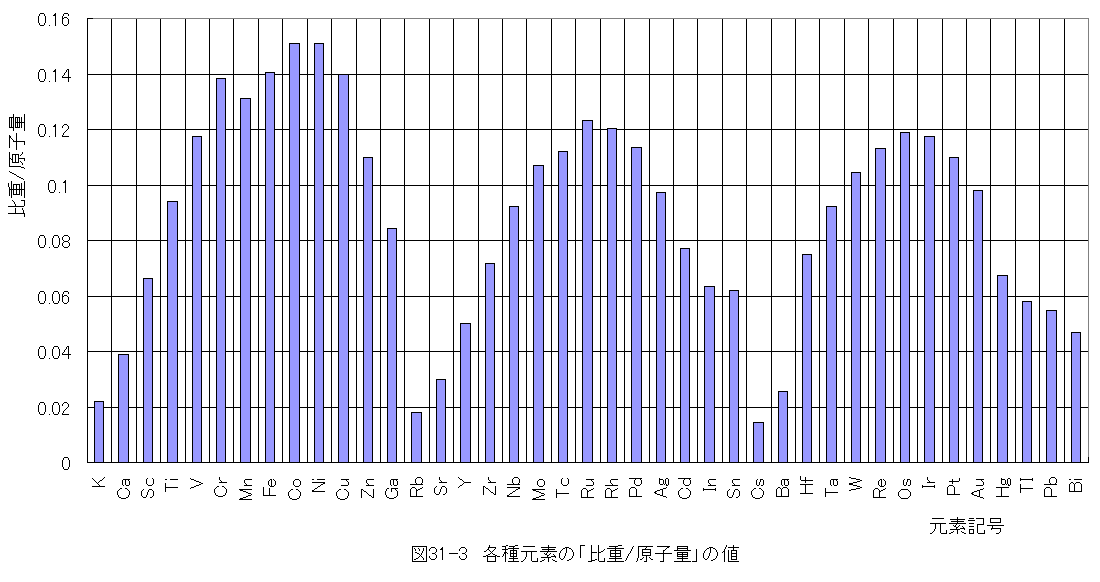
図31-3において、3個の山型になることがわかります。白金(Pt)は第3の山に所属します。第3の山にはW、Re、Os、Ir、Pt等の元素が所属します が、タングステン(W)と白金(Pt) を除いてなじみの薄い金属です。第3の山に属する金属が原子量が大きく、触媒としての効果が大きい金属と思われます。
第2の山にはMo、Tc、Ru、Rh、Pdが所属しますが、モリブデン(Mo)を除いてなじみの薄い金属です。
第1の山にはCr 、Mn、Fe、Co、Ni 、Cu等のなじみ深い金属が並びます。第1の山に所属する金属は原子量が小さくなるため、触媒としての効果が小さくなる可能性があります。
ただし、処理温度を高くするに従い、共有結合を破壊するためのエネルギーが増大しますので、原子量の小さい触媒でも効果が得られるようになるはずです。
触媒は、化学反応を促進する上で、重要な役割をはたします。