燃焼で発生する有害物質の無害化について検討してみたいと思います。
有機化合物は800℃以上の高温で原子間結合が切れて活性状態となります。そこに十分な量の酸素を供給すると酸素と結合して酸化物になります。
酸化物の多くは水に溶解し酸性となります。従って、アルカリ水溶液で中和すれば無害化できるはずです。
代表的なアルカリ水溶液としては
- 水酸化ナトリウム(NaOH)
- 水酸化カリウム(KOH)
- 水酸化カルシウム(Ca(OH)2)
- 水酸化マグネシウム(Mg(OH)2)
- 水酸化アンモニウム(NH4OH)
等があります。
2.
- 水酸化ナトリウム(NaOH)
・安全性 強アルカリで取り扱いに注意が必要
・水溶性 111g/100 ml (20 °C)
- 炭酸ナトリウム(Na2CO3)
・安全性 良好
・水溶性 22 g/100 ml (20 °C)
- 硝酸ナトリウム(NaNO3)
・安全性 良好
・水溶性 92.1 g/100 mL (25 ℃)
- 硫酸ナトリウム(Na2SO4 )
・安全性 良好
・水溶性 4.76 g/100 mL (0 ℃)
- 塩化ナトリウム(NaCl )
・安全性 良好
・水溶性 35.9 g/100 g (25 °C)
- フッ化ナトリウム(NaF )
・安全性 虫歯予防の歯磨きに微量使用されるが、安全性に関しては問題あり。
・水溶性 4.0 g / 100g水(20℃)
水酸化ナトリウム(NaOH)の取り扱いとフッ化ナトリウム(NaF )の安全性は問題。
- 水酸化カリウム(KOH)
・安全性 強アルカリで取り扱いに注意が必要
・水溶性 111g/100 ml (25 °C)
- 炭酸カリウム(K2CO3)
・安全性 良好
・水溶性 112 g/100 mL (20 °C)
- 硝酸カリウム(KNO3)
・安全性 良好
・水溶性 35.7 g/100 mL (25 ℃) - 硫酸カリウム(K2SO4 )
・安全性 良好
・水溶性 120 g/L (25 °C)
- 塩化カリウム(KCl )
・安全性 肥料となる。ただし、高濃度の静脈内投与により高カリウム血症を引き起こす。
・水溶性 34.0g/100 mL (20℃)
- フッ化カリウム(KF )
・安全性水溶液は弱アルカリ性を示しガラスを腐食する。安全性に関しては問題あり。
・水溶性 92.3 g / 100g水(18℃)
水酸化カリウム(KOH) )の取り扱いとフッ化カリウム(KF )の安全性は問題。
- 水酸化カルシウム(Ca(OH)2)
・安全性 良好
・水溶性 0.17 g / 100cm3(25℃)
- 炭酸カルシウム(CaCO3)
・安全性 良好
・水溶性 0.0015g/100 mL (25 °C) - 硝酸カルシウム(Ca(NO3)2)
・安全性 良好
・水溶性 121 g/100g水(20℃)
- 硫酸カルシウム(CaSO4 )
・安全性 良好
・水溶性 0.24 g/100 cm3 (20 ℃, 無水物)
- 塩化カルシウム(CaCl2 )
・安全性 良好
・水溶性 74.5 g/100mL (20 ℃)
- フッ化カルシウム(CaF2
) ・安全性 良好
・水溶性 不溶
取り扱いと化合物は安全性が高い。
- 水酸化マグネシウム(Mg(OH)2)
・安全性 良好
・水溶性 1.2 mg/100 cm3
- 炭酸マグネシウム(MgCO3)
・安全性 良好
・水溶性 0.001g/100 mL (25 °C)
- 硝酸マグネシウム(Mg(NO3)2)
・安全性 良好
・水溶性 125 g/100g水(20℃)
- 硫酸マグネシウム(MgSO4 )
・安全性 良好
・水溶性 25.5 g/100 mL (20 ℃)
- 塩化マグネシウム(MgCl2 )
・安全性 良好
・水溶性 54.3 g/100 cm3 (20 oC)
- フッ化マグネシウム(MgF2 )
・安全性 良好
・水溶性 0.013 g/100 mL
取り扱いと化合物は安全性が高いが、水酸化マグネシウム(Mg(OH)2)は水溶性が1.2 mg/100 cm3と小さいため効率が悪い。
- 水酸化アンモニウム(NH4OH)
・安全性 特有の強い刺激臭を持つ
・水溶性 89.9 g/100 cm3 (0 ℃)
- 炭酸アンモニウム((NH4)2CO3)
・安全性 58 °C で熱分解し、二酸化炭素とアンモニアと水に変わる。
・水溶性 可溶
- 硝酸アンモニウム (NH4 NO3)
・安全性 火薬・爆薬の原料
・水溶性 190 g/100 mL (20 ℃)
- 硫酸アンモニウム( (NH4)2SO4 )
・安全性 良好
・水溶性 74.4 g/100 mL (20 °C)
- 塩化アンモニウム( (NH4 Cl )
・安全性 良好
・水溶性 37.2 g/100 mL (20 °C)
- フッ化アンモニウム( (NH4 F )
・安全性 100℃以下の加熱によりフッ化水素アンモニウムに分解する。有毒である。
・水溶性 45.3 g/100 mL (25 ℃)
取り扱いと化合物の安全性において問題がある。
以上の中和剤の比較検討から
・水酸化カルシウム(Ca(OH)2)が最も安全な中和剤である。
・水酸化カルシウム(Ca(OH)2)は土壌の中和剤として広く利用されています。
完全燃焼で発生する有害物質の中和処理において、大量の処理廃液が発生します。
廃液は河川や海には流せません。廃液処理に最も適した技術が電気透析です。
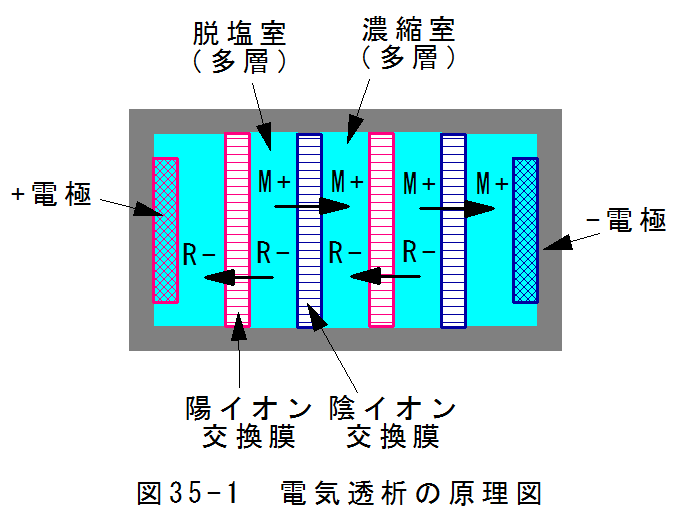
電気透析の原理を図35-1に示します。
図35-1において、両端には、プラス電極とマイナス電極が設置されます。
その間には、陽イオン交換膜と陰イオン交換膜が交互に配置された多層構造をしています。
陽イオン交換膜は陰イオンのみを透過させる性質があり、陰イオン交換膜は陽イオンのみを透過させる性質があります。
電圧をかけると陰イオンはプラス電極に引かれ、陽イオンはマイナス電極に引かれます。
このため、脱塩室と濃縮室が交互に構成されます。電極部分は電子のやり取りがあるため、異なる反応が発生します。
電気透析の技術を使用して、廃液を資源と純水に分離することが可能となります。
- フッ化カルシウム(CaF2 )
・フッ化カルシウムはホタル石の主成分であり、高価値な資源となります。
・水に不溶のため、廃液中に個体として析出します。
・炭酸カルシウム(CaCO3)とは水溶性に差があるため、分離可能です。
- 炭酸カルシウム(CaCO3)
・水酸化カルシウム(Ca(OH)2)の原料となります。
・水溶性が0.0015g/100 mL (25 °C)と小さいため、廃液中に個体として析出します。
- 硫酸カルシウム(CaSO4 )
・石膏の主成分であり、資源となります。
・水溶性が0.24 g/100 cm3 (20 ℃, 無水物)と比較的小さいため、電気透析での濃縮過程で最初に析出します。
- 塩化カルシウム(CaCl2 )
除湿剤、融雪剤、豆腐用凝固剤、食品添加物などに使用でき、資源となります。
・水溶性が74.5 g/100mL (20 ℃)が大きいため、かなり濃縮した段階で析出します。
- 硝酸カルシウム(Ca(NO3)2)
・即効性肥料、花火の火薬に利用でき、資源となります。
・水溶性が121 g/100g水(20℃)大きく、濃縮の最終段階で析出します。
- 燃焼で発生する有害物質は無害化処理によって、排出物は窒素ガス、酸素ガス、純水のみにすることが原理的に可能です。
- 窒素ガス、酸素ガス、純水を除く物質は、全て資源として再利用することが可能です。
- 燃焼で発生した二酸化炭素も無害化処理によって、全て除去できます。しかし、無害化処理には、大量の水酸化カルシウム(Ca(OH)2)を使用します。
- 水酸化カルシウム(Ca(OH)2)生産の過程で二酸化炭素が発生します。