気体は3個のパラメータ、すなわち圧力P、比容積V、温度Tで状態が表されます。この3個のパラメータの関係式が気体の基礎方程式です。
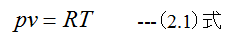
(2.1)式において、圧力pは絶対圧力で真空がゼロとなり工学単位が[kp/m2]、物理単位が[Pa]です 。温度Tは絶対温度で単位は°Kです。比容積vは工学単位が (m3/kp)、物理単位が(m3/mol) です。
(2.1)式におけるRがガス定数であり、工学単位が[m・kp/(kg・K)]、物理単位が[J/(mol ・K)]となります。
工学単位は測定・実験が容易な単位系となっており、測定・実験が容易ですが物理理論と単位が異なってしまします。
物理単位は、単位が統一されており理論検討に適します。しかし、実験の際、直接パラメータを測定できず単位の変換が必要となります。比容積で使用され るmolの値を知るためには、ガス分子の分子量の値が必要となります。ガス分子の分子量が不明の場合は、分子量の測定が必要となるわけですが、質量分析装置が 必要となってしまいます。
あるいは、標準状態(0℃、1気圧)で22.4リットルの体積ということになります。または、6.02×1023 個(アボガドロ定数)の分子数ということになりますが、 実際に分子の数を数えられるものではありません。
なぜ?1molが標準状態(0℃、1気圧)で22.4リットルの体積で、 6.02×1023 個(アボガドロ定数)の分子数なのか?これはさまざまな理論検討から決定され た数値といえます。
比容積vの代わりに体積Vを使用すると(2.1)式は
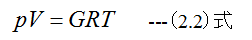
となります。(2.2)式においてGは工学単位においては、体積Vの気体の質量[kg]、物理単位においては体積Vの気体のmol量[mol]となります。
物体に取り入れられた熱エネルギーdq次の2つのものに消費される。一部は物体の内部エネルギーduを増すのに、残りは外部仕事dlを増すのに消費される。
統一工学単位においては、
熱エネルギーdq= mkp/kg
内部エネルギーdu = mkp/kg
外部仕事dl=mkp/kg
の単位が使用します。
統一工学単位における熱力学の第1法則は
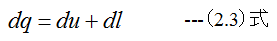
となります。
物理単位においては
熱エネルギーdq=J/mol
内部エネルギーdu =J/mol
外部仕事dl=J/mol
となります。物理単位における計算式は同一です。
各種のガスのガス定数Rの値を表2-1に示します。
表2-1 各種気体のガス定数Rの値
| 項目 | 分子量 | ガス定数(工学) | ガス定数(物理) |
| 単位 | g/mol | m・kp/kg・K | J/mol・K |
| 酸素 | 32 | 26.5 | 8.3104 |
| 水素 | 2.016 | 420.6 | 8.3097 |
| 窒素 | 28.02 | 30.26 | 8.3093 |
| 一酸化炭素 | 28 | 30.29 | 8.3116 |
| 空気 | 29 | 29.27 | 8.3185 |
| 二酸化炭素 | 44 | 19.28 | 8.3135 |
| アセチレン | 26.016 | 32.6 | 8.3116 |
| メタン | 16.032 | 52.9 | 8.3113 |
| エチレン | 28.032 | 30.25 | 8.3101 |
表2-1の各種気体のガス定数(工学)の値は実験的に求められた値と思われます。ガス定数(物理)はガス定数(工学)の値を変換した値です。
ガス定数(物理)ではほぼ一定の値になることがわかります。値のバラツキは、実験における測定誤差と考えることもできます。
現在のガス定数(物理) の値は8.314 4621 J K-1 mol-1 (2010年CODATA)とされています。
3章以降は記載の都合で工学単位、または統一工学単位を使用します。計算式は全て統一工学単位とします。物理単位の計算式と統一工学単位の計算式は一致します。